Сульфатна кислота – Елементи VIA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.3. Елементи VIA Групи
9.3.10. Сульфатна кислота
Сульфатна кислота H2SO4 – це речовина молекулярної будови. Атом Сульфуру утворює шість ковалентних зв’язків і набуває ступеня окиснення +6:
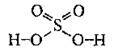
Безводна сульфатна кислота – це важка, оліїста рідина без кольору і запаху, нелетка. Дуже гігроскопічна, змішується з водою у будь-яких співвідношеннях. Розчинення
Розчин кислоти з масовою часткою H2SO4, меншою за 70 %, називають розбавленою, а якщо масова частка більша за 70 %, то концентрованою. Найчастіше в лабораторіях використовують концентрований розчин з масовою часткою H2SO4 96 % (густина – 1,84 г/мл).
Добування сульфатної кислоти
Найважливішим промисловим способом добування сульфатної кислоти є контактний спосіб. Процес одержання відбувається у три стадії:
1. Одержання сульфур(ІV) оксиду шляхом
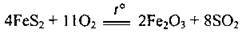
2. Окиснення сульфур(ІV) оксиду до сульфур(VІ) оксиду. Реакція є оборотною, екзотермічною і каталітичною. Каталізаторами реакції є платина, або ванадій(V) оксид V2O5. Оптимальна температура реакції – 400-470 °С:
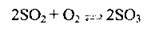
3. Розчинення сульфур(VІ) оксиду в сульфатній кислоті:
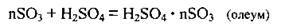
Потім до олеуму додають воду, одержуючи кислоту необхідної концентрації:
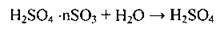
Хімічні властивості сульфатної кислоти
Сульфатна кислота – це сильна, двохосновна кислота. Відзначається високою реакційною здатністю. Розбавлена сульфатна кислота – сильний електроліт, виявляє типові властивості кислот.
1. Як двохосновна кислота дисоціює ступенево з утворенням гідрогенсульфат-іонів та сульфат-іонів:
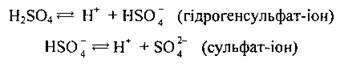
Сульфатна кислота сильна, її дисоціація за першим ступенем відбувається майже повністю.
2. Розбавлена сульфатна кислота реагує з металами, які розміщуються у витискувальному ряду зліва від водню, з основними й амфотерними оксидами, з основами, утворюючи кислі та середні солі, з деякими солями:

Взаємодія йонів Ва2+ і SO42- приводить до утворення білого осаду BaSO4, нерозчинного у воді та кислотах.
2. Концентрована сульфатна кислота як сильна і нелетка кислота витісняє леткі кислоти з їхніх солей:
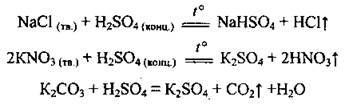
3. При нагріванні вище 200 °С безводна сульфатна кислота частково розкладається:
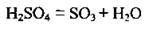
4. Концентрована сульфатна кислота здатна відбирати воду від органічних речовин, при цьому вона їх обвуглює – розкладає до вуглецю:
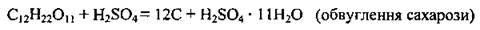
5. Окисні властивості сульфатної кислоти.
Розбавлена сульфатна кислота виявляє слабкі окисні властивості за рахунок йонів Н+, що й спостерігається в реакціях з металами:
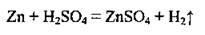
Концентрована сульфатна кислота при нагріванні виявляє сильні окисні властивості. Це зумовлено тим, що Сульфур у кислоті має найвищий ступінь окиснення – +6. Концентрована сульфатна кислота окислює ті метали, які розміщуються у витискувальному ряду зліва від водню, і ті, що розміщуються справа від нього; При цьому Сульфур може відновлюватися до сірководню, сірки або сульфур(ІV) оксиду:
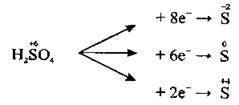
Ступінь окиснення, якого набуває Сульфур у продуктах відновлення, залежить від концентрації сульфатної кислоти і від природи іншого реагенту (відновника): що сильніший відновник, з якими реагує кислота, то глибше відбувається процес відновлення:
А) малоактивні метали (Cu, Hg, Ag) відновлюють концентровану сульфатну кислоту до сульфур(ІV) оксиду:
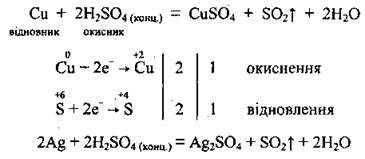
Б) найактивніші метали (лужні та лужноземельні) відновлюють концентровану сульфатну кислоту до сірководню:
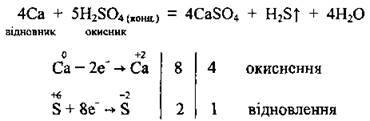
В) метали середньої активності (Zn, Al, Mg), залежно від концентрації кислоти, одночасно можуть відновлювати концентровану сульфатну кислоту до різних продуктів відновлення – сірки, сірчистого газу та сірководню:
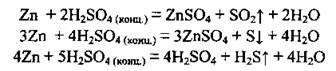
Г) концентрована сульфатна кислота за стандартних умов не реагує із залізом, алюмінієм, хромом. Це пов’язано з тим, що на поверхні металу утворюється тоненька плівка оксиду, яка є інертною щодо кислоти за цих умов. Такий процес називають пасивацією1. При нагріванні ці метали розчиняються в кислоті, утворюючи солі з вищим ступенем окиснення металу:
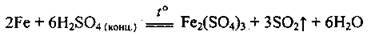
При нагріванні із сульфатною концентрованою кислотою практично реагують усі метали, крім золота і платини. Концентрована сульфатна кислота окислює також неметали:
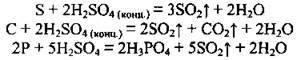
Концентрована сульфатна кислота окиснює бромід та іодид-іони до вільних галогенів, однак не може окислювати хлорид-іони до С12, що дає змогу добувати НСl із солей при її участі:
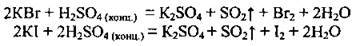
Солі сульфатної кислоти
Як двохосновна кислота сульфатна кислота утворює два ряди солей: середні, які називають сульфатами, і кислі – гідрогенсульфати. Серед сульфатів є солі, що містять кристалізаційну воду; деякі з них називають купоросами.
Сульфати (середні солі) | CaSO4, K2SO4, Al2(SO4)3 |
Гідрогенсульфати (кислі солі) | KHSO4, Zn(HSO4)2, Al(HSO4)3 |
Купороси – це кристалогідрати сульфатів металічних елементів: Fe, Cu, Zn, Ni, Co | CuSO4 · 5H2O – мідний купорос, (купрум(ІІ) сульфат пентагідрат) FeSO4 · 7Н2O – залізний купорос, (ферум(ІІ) сульфат гептагідрат) ZnSO4 · 7Н2O – цинковий купорос (цинк сульфат гептагідрат) |
Інші важливі кристалогідрати | 2CaSO4 · Н2O – алебастр CaSO4 · 2Н2O – гіпс, кальцій сульфат дигідрат Na2SO4 · 10Н2O – глауберова сіль, натрій сульфат декагідрат |
Галуни (подвійні солі) | KAl(SO4)2 · 12Н2O – алюмокалієвий галун |
Хімічні властивості сульфатів
1. Сульфати виявляють загальні властивості солей: взаємодіють з металами, деякими кислотами та солями:
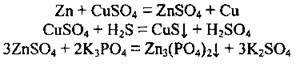
2. Під час нагрівання:
А) сульфати активних металів (лужних та деяких лужноземельних) не розкладаються навіть при 1000 °С;
Б) сульфати металічних елементів середньої активності розкладаються на оксид і сульфур(VІ) оксид:
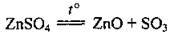
В) сульфати Cu, Fe, Al розкладаються навіть при незначному нагріванні:
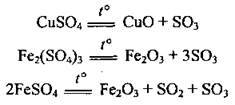
Г) сульфати деяких металічних елементів розкладаються з утворенням металу, сульфур(IV) оксиду і кисню:
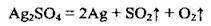
Використання сульфатної кислоти та сульфатів
Сульфатну кислоту використовують для добування вибухових речовин, як осушувач газів, у процесі переробки руд; виробництва ортофосфатної кислоти і фосфорних добрив, лікарських препаратів та низки органічних речовин (волокон, пластмас, барвників); для очищення нафтопродуктів, поверхонь металевих виробів перед нанесенням захисного покриття; як електроліт в акумуляторах.
Магній сульфат гептагідрат MgSO4 · 7Н2O та натрій сульфат декагідрат Na2SO4 · 10Н2O використовують у медицині як проносний засіб.
Галуни (подвійні солі із загальною формулою Me+Me3+(SO4)2 · 12Н2O) застосовують у медицині, а також під час процесу фарбування тканин та дублення шкіри.
Гіпс та кальцій сульфат використовують у медицині та будівництві.
Калій сульфат та амоній сульфат застосовують як добрива.
Барій сульфат використовують у виробництві паперу, гуми, білої мінеральної фарби, а також у медицині для проведення рентгеноскопії травної трубки.
Мідний та залізний купорос застосовують у сільському господарстві для боротьби зі шкідниками і хворобами рослин; у виробництві фарб, для просочення деревини (для боротьби зі шкідниками) та як антисептичний засіб.
Натрій сульфат інколи використовують замість інших солей Натрію під час виробництва скла і соди.
______________________________________________________
1 Оскільки залізо пасивується концентрованою сульфатною кислотою, її транспортують і зберігають у залізних цистернах.