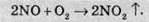Сульфатна кислота – ОКСИГЕН. СУЛЬФУР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ОКСИГЕН. СУЛЬФУР
Сульфатна кислота
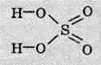
Структурна формула сульфатної кислоти має такий вигляд:
Фізичні властивості сульфатної кислоти
Сульфатна кислота – це безбарвна, важка, масляниста рідина, яка замерзає при температурі +10 °С, а кипить при температурі +296 °С (кипить 98,3 % розчин, а надлишок сульфатної кислоти розкладається на сульфатний ангідрид та воду). Густина сульфатної кислоти при +20 °С
Ця сполука дуже гігроскопічна, тобто здатна поглинати вологу з навколишнього середовища. При цьому виділяється велика кількість теплової енергії. Якщо долити воду до сульфатної кислоти, може виділитися стільки енергії, що кислота закипить і почне розбризкуватися навсібіч, тому для того, щоб розвести концентровану сульфатну кислоту, слід кислоту додавати невеликими порціями до води.
Сульфатна кислота здатна розчиняти близько 65% сульфатного ангідриду
Хімічні властивості сульфатної кислоти
Сульфатна кислота є дуже сильним окисником. У розведених розчинах окиснення проходить за рахунок iона Гідрогену, а в концентрованих розчинах – за рахунок атома Сульфуру(VІ).
Кислотні властивості сульфатної кислоти
Сульфатна кислота – це одна з найсильніших кислот. У розведених розчинах вона являє собою двохосновну кислоту, яка піддається дисоціації за такою схемою:
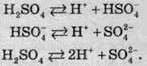
Сульфатна кислота, так само, як і сульфітна, утворює два ряди солей. До них належать сульфати (наприклад, BaSO4 – барій сульфат) та гідрогенсульфати (NaHSO4 – натрій гідрогенсульфат). Сульфатна кислота енергійно реагує з різними основами й основними оксидами, при цьому утворюються сульфати:
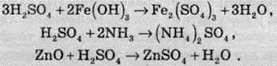
Реагує вона и з металами, які пересувають у ряді стандартних електродних потенціалів до водню:
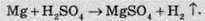
А от із залізом концентрована сульфатна кислота (≥ 75%) не реагує, тому її зазвичай перевозять у сталевих бочках та цистернах. Сульфатна кислота не реагує також і зі свинцем, оскільки поверхня металу покривається міцною плівкою нерозчинного плюмбум(ІІ) сульфату PbSO4, і на цьому процес зупиняється.
Окисні властивості сульфатної кислоти
У концентрованих розчинах при нагріванні сульфатна кислота реагує з багатьма металами, навіть із деякими з тих, які перебувають в електрохімічному ряді напруг правіше водню:
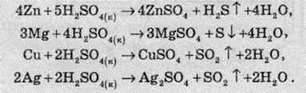
Продукти відновлення сульфатної кислоти, записані в цих реакціях, не є єдиними. Загалом, у всіх цих реакціях утворюється суміш H2S, S, SO2, склад якої залежить від багатьох умов (концентрації кислоти, температури суміші, площі поверхні металу тощо), але записаний продукт у них є переважним.
При нагріванні концентрована сульфатна кислота добре реагує з багатьма неметалами:
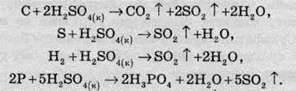
Сульфатна кислота окислює багато складних сполук:
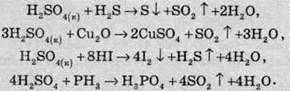
Від більшості органічних сполук вона відщеплює молекули води, що призводить до обвуглювання сполуки. Наприклад, якщо на папір помістити краплю сульфатної кислоти, то через кілька секунд на місці цієї краплі утвориться чорна пляма, яка складається з вуглецю:
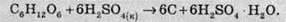
Значення сульфатної кислоти в народному господарстві
Сульфатна кислота – це найважливіший продукт хімічної промисловості. Світове виробництво сульфатної кислоти за рік складає сотні мільйонів тонн.
Сульфатну кислоту використовують для виробництва різних летких кислот, наприклад, хлоридної, оцтової, ортофосфатної, нітратної та інших, а також для виробництва азотних і фосфатних добрив (суперфосфату, амоній фосфату тощо). Сульфатна кислота необхідна у виробництві пластмас, паперу, будівельних матеріалів, тканин, лакофарбових виробів та мийних засобів. Її застосовують для очищення нафти, нафтопродуктів і продуктів коксохімічного виробництва (бензену й толуену) від шкідливих домішок. Для виробництва ефірів, ангідридів органічних кислот і різних сульфопохідних також необхідна сульфатна кислота. У металургійній промисловості її застосовують для очищення поверхні металів перед нанесенням покриття. Розчин сульфатної кислоти використовують як електроліт у кислотних акумуляторах.
Сульфатна кислота незамінна в народному господарстві.
Виробництво сульфатної кислоти
Сульфатну кислоту добувають двома різними методами: контактним і нітрозним. Незалежно від методу добування, завжди присутні три основні етапи:
– добування SO2;
– окиснення SO2 в SO3;
– добування сульфатної кислоти.
Сульфітний ангідрид SO2 зазвичай добувають випалом піриту (FeS2) як побічний продукт при виплавці заліза. Замість піриту використовують також деякі інші сульфіди (CdS, ZnS) або сірководень, виділений із природного газу та нафти чи отриманий при коксуванні вугілля. Іноді використовують просту речовину сірку.
Контактний метод добування сульфатної кислоти
Перед випалом пірит подрібнюють для прискорення горіння. Для збільшення виходу сульфітного ангідриду в піч для випалу піриту додатково подають надлишок кисню. Проходить така реакція:
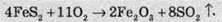
Схема промислової установки для виробництва сульфатної кислоти за контактним методом зображена на малюнку:
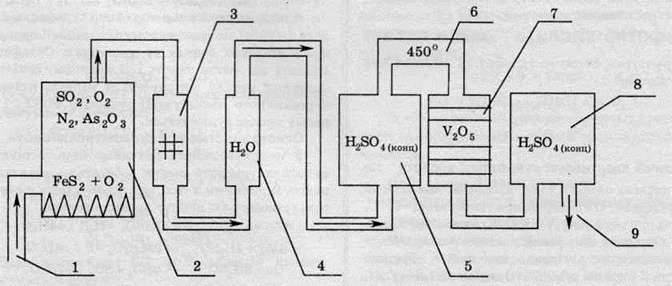
Процес роботи цієї установки полягає ось у чому. У печі (2) відбувається спалювання піриту. Кисень для горіння подають через трубу (1). Оскільки в природному мінералі піриту міститься близько 20% домішок, то після випалу, звісно ж, у газах також будуть домішки. Однією з таких домішок є арсен(ІІІ) оксид. Ця сама по собі небезпечна для навколишнього середовища речовина є каталітичною отрутою, тобто вона порушує роботу каталізатора. Для вилучення цієї шкідливої домішки газову суміш пропускають через спеціальні електричні фільтри (3) та промивну башту з водою (4). Після промивання водою суміш стає вологою, і, задля вилучення домішок води, суміш пропускають через колонку з концентрованою сульфатною кислотою (5), яка ефективно поглинає вологу. Далі газову суміш нагрівають у теплообміннику (6) до температури 450°, і суміш потрапляє в контактний апарат (7), в якому перебуває каталізатор V2O5 (у ролі каталізатора іноді використовують також ванадил сульфат VOSO4, платину або срібло). Після цього утворений сульфур триоксид розчиняють у концентрованій сульфатній кислоті (8), внаслідок чого утворюється олеум, яким заповнюють цистерни за допомогою виводу готового продукту (9).
Нітрозний метод добування сульфатної кислоти
Близько 20% сульфатної кислоти, яку виробляють у світі, добувають нітрозним, або баштовим, методом. У цьому методі окиснення SO2 в SO3 здійснюється нітроген діоксидом NO2:
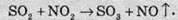
Нітроген діоксид в цьому методі регенерується за допомогою кисню повітря й знову вступає в реакцію окиснення сульфур(ІV) оксиду: