Теорія як вища форма наукових знань. Теорія хімічної будови органічних речовин О. М. Бутлерова
УРОК 1
Тема. Теорія як вища форма наукових знань. Теорія хімічної будови органічних речовин О. М. Бутлерова
Цілі: актуалізувати знання учнів про форми, в яких виражаються наукові знання, ознайомити з передумовами створення теорії хімічної будови органічних речовин, вивчити основні положення теорії; вміти пояснювати й наводити приклади основних положень теорії хімічної будови органічних речовин О. М. Бутлерова.
Обладнання: куле-стрижневі моделі, мультимедійний проектор.
Тип уроку: ВП, ВНМ(О).
Форми проведення: бесіда, прийом
ХІД УРОКУ
I. Організація класу
II. Оголошення теми й мети уроку
III. Актуалізація опорних знань. Вступне повторення
1. Активізація знань учнів про основні наукові методи пізнання
Необхідно згадати з курсів інших предметів, що таке аксіома, теорема, правило, теорія, закон.
2. Установлення аналогії між відкриттям Д. І. Менделєєвим періодичного закону і створенням О. М. Бутлеровим теорії хімічної будови
3. Повторення курсу хімії 7 класу: основні методи наукового пізнання
4. Складання на дошці й у зошитах узагальнюючої схеми або проектування
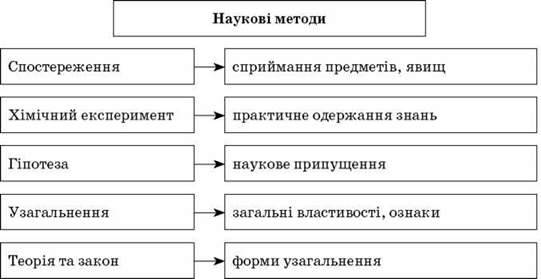
Звертаємо увагу учнів, що теорія і закон є основними формами узагальнення накопичених знань, що закон відкривають, а теорію створюють. Учні мають усвідомити, що закон існує у природі незалежно від наших уявлень, тому його неможливо створити, а тільки відкрити й потім підтверджувати його правильність. Теорія може створюватися на певному етапі розвитку науки в результаті накопичення нею певних знань. Вона може розвиватися, доповнюватись або просто відмирати, якщо її спростує інша теорія.
5. Повторення навчального матеріалу 9 класу: валентність Карбону в органічних сполуках і написання структурних формул вуглеводнів
IV. Мотивація навчальної діяльності
Подібно до того, як у неорганічній хімії під час вивчення елементів та їх сполук ми керуємося періодичним законом і періодичною системою хімічних елементів, так у органічній хімії ми будемо керуватися теорією хімічної будови органічних речовин О. М. Бутлерова.
V. Вивчення нового матеріалу
Використовуємо інтерактивну технологію “Спільний проект”. Об’єднуємо клас у групи. Кожна група отримує завдання: опрацювати та представити класу одне з положень теорії будови органічних речовин О. М. Бутлерова. Одна з груп, яка складається із сильних учнів, буде експертною й доповнюватиме доповіді учнів.
Вивчення нового матеріалу можна почати словами з листа Ф. Велера до Я. Берцеліуса: “Органічна хімія може зараз кого завгодно звести з глузду. Вона уявляється мені дрімучим лісом, повним дивних речей, безмежною хащею, з якої неможливо вибратися, куди не насмілишся проникнути”.
Хімія того часу, як і зараз, невід’ємна від економічного розвитку, який стрімко набирав обертів і потребував нових речовин (барвників, лікарських препаратів нових методів переробки сільськогосподарських продуктів і природних сполук для їх практичного використання. Отже, потрібна була теорія, яка б пояснювала накопичені на той час факти існування молекул, атомів, їх сполуки, існування ізомерів, хімічну будову речовин, вплив будови речовин на їх властивості, причини різноманітності органічних сполук.
Таку теорію створив російський учений О. М. Бутлеров. Розглянемо основні її положення. (Орієнтовні доповіді груп)
І. Атоми в молекулах з’єднані не безладно, а в певній послідовності, згідно з їх валентністю.
О. М. Бутлеров припускав, а ми вже знаємо, що Карбон в органічних сполуках чотиривалентний. При цьому атоми Карбону можуть сполучатися один з одним або з атомами різних елементів. Дослідження будови атомів і природи хімічного зв’язку підтвердили ці припущення. З курсу органічної хімії 9 класу ми вже знаємо, що хімічну будову молекул органічних речовин записують з допомогою структурних формул, у яких зазначають усі їхні хімічні зв’язки між атомами (зображають рискою). Згідно з електронною теорією, одна риска в структурних формулах означає електронну пару, що утворює ковалентний зв’язок. Наприклад, для етану С2Н6

II. Властивості речовин залежать не тільки від того, які атоми й у якій послідовності входять до складу молекул, а й від порядку сполучення атомів у молекулі.
На той час уже було відомо, що формулі бутану С4Н10 відповідають речовини різної будови, що О. М. Бутлеров довів експериментально.
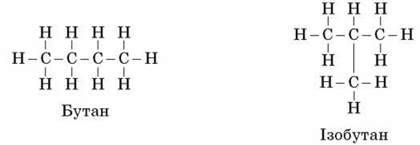
Це стосується також глюкози та фруктози, формула яких С6Н12О6, а властивості різні.
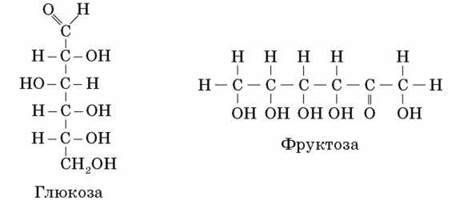
Такі речовини називають ізомерами. Ізомери мають однаковий склад, але різну будову молекул, а тому й різні властивості. Тобто властивості речовин залежать від їх будови. Явище ізомерії пояснює багатоманітність органічних речовин.
III. Атоми та групи атомів взаємно впливають один на одного.
Так, можна розглянути реакційну здатність до реакцій заміщення метану та хлорметану. Хлорметан, через наявність у його молекулі атома Хлору, більш реакційноздатний. Хлор як більш електронегативний елемент відтягує на себе електронні густини зв’язків атомів Карбону й Гідрогену, вони слабшають, і атоми Гідрогену легше заміщаються.

Але Хлор у молекулі хлорметану також зазнав впливу карбонового радикала. Він не відщеплюється у вигляді хлорид-іону й не дає осаду з аргентум нітратом. Отже, вплив атомів взаємний.
Також можна розглянути будову карбоксильної групи в карбонових кислотах. Унаслідок впливу більш електронегативного атома Оксигену карбоксильної групи атом Гідрогену стає більш рухливим і легше заміщується.
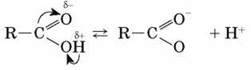
Це пояснює кислотні властивості карбонових кислот.
IV. Знаючи властивості речовин, можна передбачити їх будову, і навпаки, знаючи будову речовин, можна передбачити їх властивості.
Це положення можна пояснити на прикладі спиртів. їх молекули складаються з карбонового радикала й гідроксильної групи. Отже, виходячи з наявності гідроксильної групи та її будови, можна передбачити властивості спиртів.
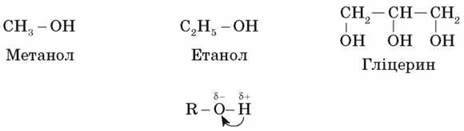
Через полярність зв’язку О-Н Гідроген стає більш рухливим та легко заміщується, наприклад, на метал. І навпаки, якщо складна речовина може взаємодіяти з металами, то можна передбачити, що в її будові може бути гідроксильна група.
VI. Закріплення й усвідомлення знань
Прийом “Творча лабораторія”
Пропонуємо учням, користуючись куле-стрижневими моделями або пластиліном білого й чорного кольорів та зубочистками, скласти моделі речовин бутану й ізобутану, а потім на цьому прикладі скласти моделі, які будуть відповідати формулі пентану С5Н12.
VII. Підбиття підсумків уроку
VIII. Домашнє завдання