Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння
Тема 2
ХІМІЧНІ РЕАКЦІЇ
Урок 24
Тема уроку. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння
Цілі уроку: розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; ознайомити учнів з поняттями “тепловий ефект хімічної реакції”, “термохімічні рівняння”; формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування
Форми роботи: фронтальне опитування, демонстраційний експеримент, групова робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, плакат із правилами техніки безпеки в кабінеті хімії.
Демонстрація 6. Реакції екзо – й ендотермічні.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань.
Мотивація навчальної діяльності
1. Хімічний диктант
(Учні по ланцюжку відповідають на запитання.)
– Які типи хімічних реакцій ви знаєте?
– За якими ознаками класифікують хімічні реакції?
–
– Що відбувається під час реакції розкладу?
– Які реакції називаються реакціями заміщення?
– Що відбувається під час реакцій обміну?
– Які типи хімічних реакцій включає класифікація за тепловим ефектом?
– Що таке швидкість хімічної реакції?
– Які фактори впливають на швидкість хімічної реакції?
– У чому полягає вплив природи реагентів на швидкість хімічних реакцій?
– Як пояснити вплив концентрації реагентів на швидкість реакції?
2. Перевірка домашнього завдання
Під час хімічного диктанту двоє учнів пишуть його на дошці.
ІІІ. Вивчення нового матеріалу
Тепловий ефект хімічних реакцій. Термохімічні рівняння
Завдання 1. Визначте тип хімічної реакції за тепловим ефектом хімічної реакції. (Рівняння записані на дошці або проектуються на екрані.)
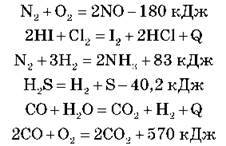
З великої кількості хімічних реакцій можна вибрати ті, що протікають мимовільно, і ті, для яких необхідна додаткова енергія ззовні.
Які реакції називаються екзотермічними?
Екзотермічними є реакції, що протікають із виділенням тепла.
Які реакції називаються ендотермічними?
Ендотермічними є реакції, що протікають із поглинанням тепла.
Теплота, що поглинається або виділяється в процесі хімічної реакції, називається тепловим ефектом реакції.
Тепловий ефект показує різницю між умістом внутрішньої енергії вихідних речовин і продуктів реакції. Умовно можна записати:
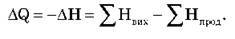
Хімічне рівняння, у якому визначено тепловий ефект хімічної реакції, називається термохімічним рівнянням. (Звертаємо увагу на рівняння, записані на дошці.)
Завдання 2
Укажіть тип хімічних реакцій. Які з цих реакцій – екзотермічні?

IV. Первинне застосування одержаних знань (керована практика)
Такі рівняння можна використати для хімічних розрахунків.
Завдання 1. У процесі згоряння 12 г вуглецю виділяється 393 кДж тепла. Запишіть термохімічне рівняння.
C + О2 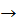 CО2 + 393 кДж/моль
CО2 + 393 кДж/моль
Або
C + О2 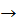 CО2; ?H = -393 кДж.
CО2; ?H = -393 кДж.
Завдання 2. Для взаємодії азоту з киснем необхідно 180,5 кДж тепла. Запишіть термохімічне рівняння.
N2 + О2  2NО -180,5 кДж/моль
2NО -180,5 кДж/моль
Або
N2 + О2  2NО; ?H = +180,5 кДж.
2NО; ?H = +180,5 кДж.
Завдання 3. Обчисліть, яка кількість тепла виділиться внаслідок спалювання 1 м3 метану, якщо термохімічне рівняння горіння метану:
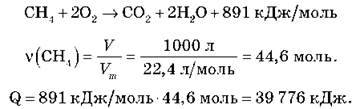
Відповідь: 39 776 кДж.
Завдання 4. Обчисліть, яка маса цинку окислилася, якщо в результаті реакції поглинулося 174,5 кДж/моль тепла. Термохімічне рівняння:
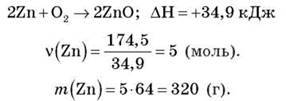
Відповідь: 320 г цинку.
Для виконання наступного завдання клас об’єднується в групи, після виконання відповіді обговорюються, коригуються, оцінюються учнями в класі.
Завдання 5. Уявіть себе хіміком-технологом на заводі й охарактеризуйте хімічну реакцію за всіма відомими вам ознаками. Запропонуйте умови, за яких швидкість реакції буде максимальною.
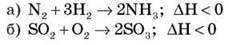
Завдання 6. Учень спалює однакову кількість сірки на повітрі й у циліндрі з киснем. Де реакція протікатиме швидше? Чому?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання. Підготуйте розповідь про значення каталітичних реакцій, про ферменти та їх значення для людини.