Відносна густина газів. Обчислення відносної густини
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 8
Тема. Відносна густина газів. Обчислення відносної густини
Цілі уроку: розкрити суть поняття “відносна густина газів”; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, керована практика, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
1. Звіряємо відповіді в задачах, коментуємо, відповідаємо на запитання учнів.
2. Заповнюємо таблицю на дошці й у зошитах, проводячи розрахунки усно (умови нормальні).
Формули для розрахунку записуємо на дошці:
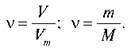
Формула газу | Кількість речовини | Молярна маса | Маса | Об’єм |
N2 | 1 | 28 г/моль | 28 г | 22,4 л |
O2 | 0,5 моль | 32 г/моль | 16 г | 11,2л |
H2 | 1 моль | 2 г/моль | 2 г | 22,4 л |
CO2 | 2 моль | 44 г/моль | 88 г | 44,8 л |
CH4 | 2 моль | 16 г/моль | 32 г | 44,8 л |
NH3 | 0,5 моль | 17 г/моль | 8,5 г | 11,2л |
Яким законом ми скористалися, щоб обчислити об’єм газів? (Законом Авогадро)
III. Виклад нового матеріалу
Розповідь учителя
З таблиці на дошці видно, що однакова кількість речовини різних газів займає однаковий об’єм, але має різну масу, як і різну молярну масу. Тобто гази мають різну густину. Порівняємо густину двох газів кількістю речовини 1 моль за н. у.
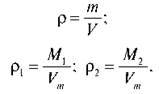
Тоді співвідношення густин:
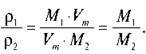
Таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
D = M1/M2,
Звідси M1 = D – M2.
Отже, за молярною масою відомого газу можна визначити густину будь-якого газу.
Демонстрація
1. Зважуємо закриту колбу з повітрям на терезах.
2. Заповнюємо колбу киснем, закорковуємо та зважуємо.
3. Обчислюємо співвідношення маси колби з повітрям і киснем, це й буде відносна густина, оскільки об’єм колби однаковий, а отже, і кількість речовин однакова.
4. M2(O2) = 32 г/моль.
За формулою М1 = D – M2 обчислюємо молярну масу повітря в кімнаті.
IV. Закріплення вивченого матеріалу
Керована практика
Задача 1
Обчисліть відносну густину карбон(ІV) оксиду за киснем.
Розв’язання
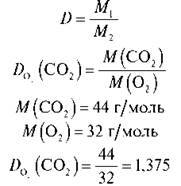
Відповідь: 1,375.
Задача 2
Обчисліть відносну густину сульфур(ІV) оксиду SO2 за воднем Н2.
(Відповідь: 32)
Задача 3
Густина невідомого оксиду Нітрогену за воднем дорівнює 38. Обчисліть молярну масу цього оксиду, визначте його формулу.
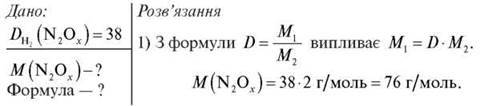
2) Визначаємо формулу. Складемо рівняння:
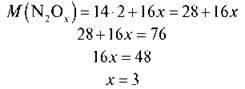
Відповідь: N2O3; M (N2O3) = 76 г/моль.
Задача 4
Густина метану за гелієм дорівнює 4. Обчисліть молярну масу метану й виведіть його формулу.
(Відповіді,: 16 г/моль; СН4)
Задача 5
Обчисліть об’єм водню, що взаємодіє з киснем об’ємом 3 л.
Дано:
V(O2) = 3 л
V(H2) – ?
Розв’язання
Для розв’язання цієї задачі ми скористаємося наслідком із закону Авогадро – законом об’ємних відносин: “Об’єми газоподібних речовин, що беруть участь у реакції, співвідносяться між собою як відповідні стехіометричні коефіцієнти”.
Рівняння реакції:
2Н2 + O2 = 2Н2O
За рівнянням: 2л 1л
За умовою: хл 3л
Складемо пропорцію:
2/x = 1/3;
Х = 6 (л).
Відповідь: 6 л.
Задача 6
Обчисліть об’єм хлору, що вступив у реакцію з воднем об’ємом 7 л. (Відповідь: 7 л)
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання.
Творче завдання (домашня практика). Самостійно розв’язати задачі. Використовуючи знання про газоподібні речовини, скласти й розв’язати задачі, аналогічні задачі 2.