Визначення – Швидкість реакції
ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
2. Швидкість реакції
У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується.
Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції.
2.1. Визначення
Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу:

∆n – зміна кількості речовини за час реакції;
∆t – час зміни кількості речовини.
У реакціях,
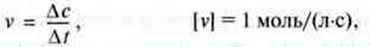
∆с – зміна концентрації речовини під час реакції;
∆t – час зміни концентрації.
У реакції, в якій беруть участь гази, для визначення швидкості реакції визначається час зміни відповідного об’єму газу:
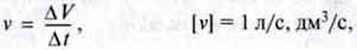
∆V – зміна об’єму газу під час реакції;
∆t – час зміни об’єму.
У реакції, в якій беруть участь тверді речовини, визначається час зміни маси відповідної речовини:

∆m – зміна маси під час реакції;
∆t – час зміни маси.
Related posts:
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Середня і миттєва швидкість – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.2 . Середня і миттєва швидкість У ході реакції її швидкість зазвичай зменшується. Тобто швидкість реакції непостійна. Наведені вище значення швидкості є лише середніми значеннями. Математично середня швидкість у певному інтервалі часу між t1 і t2 визначається з нахилу січної на діаграмі залежності концентрації від часу. Увага: при експериментальному […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 23 Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; […]...
- ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Швидкість реакції – це кількість речовини, що реагує за одиницю часу. Залежно від умов одна і та ж реакція може протікати з різною швидкістю. Так, при збільшенні кількості речовини, що реагує в одиниці об’єму, тобто його концентрації, швидкість реакції зростає, тому що зростає число зіткнень частинок, що […]...
- Швидкість хімічних реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.1. Швидкість хімічних реакцій Суть хімічних реакцій зводиться до розриву зв’язків у вихідних речовинах і виникнення нових зв’язків у продуктах реакції. При цьому загальне число атомів кожного елемента до і після реакції залишається сталим. Оскільки утворення […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- КАТАЛІЗ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ КАТАЛІЗ Каталіз – це зміна швидкості хімічної реакції речовинами (каталізаторами), які беруть участь у реакції, але не входять до складу кінцевих продуктів. За участю каталізатора хімічна рівновага системи досягається швидше, ніж без нього. Вплив у каталізатора на швидкість реакції досягають за рахунок […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ Кількість теплоти Q, яку передали системі, йде на зміну її внутрішньої енергії ΔUі на здійснення системою роботи* W проти зовнішніх сил (зовнішнього тиску р) (рис. 32): Рис. 32. Робота, яку виконує хімічна система проти зовнішнього тиску (поршень невагомий). Вуглекислий газ, який […]...
- Визначення молярної маси – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 1.3 . Визначення молярної маси У газах і рідинах, що легко випаровуються, використовують основну залежність, яка полягає в тому, що 1 моль речовини в газоподібному стані за нормальних умов займає об’єм V = 22,4 літра. Зважена порція речовини леткої рідини випаровується, а об’єм газу, який утворився, вимірюють за наявної температури і тиску, […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- Хімічні реакції. Окисно-відновні реакції I СЕМЕСТР ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.) УРОК 4 Тема уроку. Хімічні реакції. Окисно-відновні реакції Цілі уроку: актуалізувати знання учнів про хімічні реакції; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних та окисно-відновних рівнянь реакції; узагальнити уявлення учнів про швидкість хімічної реакції, хімічну рівновагу й фактори, що впливають на швидкість […]...
- Реакції в гетерогенному і гомогенному середовищі ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Більшість хімічних реакцій “миттєво” не відбуваються. Для реакції між початковими речовинами й утворенням продуктів потрібний певний час, який може бути дуже коротким. Запам’ятайте: реакції між Іонами відбуваються, як правило, набагато швидше, ніж реакції між молекулами. 1. Реакції в гетерогенному і гомогенному середовищі Реакції можуть відбуватися між речовинами в гетерогенному середовищі (наприклад, суміші […]...
- Рівномірний прямолінійний рух. Швидкість рівномірного прямолінійного руху МЕХАНІКА РОЗДІЛ 2. МЕХАНІЧНИЙ РУХ § 17. Рівномірний прямолінійний рух. Швидкість рівномірного прямолінійного руху Запитання до вивченого 1. Рівномірним рухом називають такий рух, під час якого тіло за будь-які однакові інтервали часу проходить однаковий шлях. Прикладом рівномірного руху є рух точки земної поверхні під час обертання Землі навколо своєї осі. За рівномірний рух можна прийняти […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 24 Тема уроку. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Цілі уроку: розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; ознайомити учнів з поняттями “тепловий ефект хімічної реакції”, “термохімічні рівняння”; формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням. Тип уроку: […]...
- РЕАКЦІЇ ОБМІНУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ОБМІНУ Реакції між складними хімічними речовинами, в результаті яких відбувається обмін між ними окремими атомами або групами атомів, називаються реакціями обміну. Наприклад: Реакції обміну (крім сильно екзотермічної реакції нейтралізації) зазвичай супроводжуються невеликим тепловим ефектом, тобто відбувається лише невелика зміна внутрішньої енергії системи, і вона не може бути […]...
- Хімічні реакції. Схеми реакцій, хімічні рівняння – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.1. Хімічні реакції. Схеми реакцій, хімічні рівняння Хімічними реакціями називають перетворення однієї чи декількох речовин, які відрізняються одна від одної складом чи будовою молекули, на інші. Речовини, які вступають у хімічні реакції, називають вихідними речовинами, або реагентами, а речовини, які […]...
- Хімічна рівновага – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімічна рівновага Оборотні реакції Часто напрям реакції залежить від умов її проведення. Наприклад, за звичайних умов переважно відбувається реакція: Однак при нагріванні до високої температури майже до тисячі градусів, починає переважати зворотна реакція розкладання кальцій карбонату: Проте […]...
- Швидкість – Кінематика 5. Механіка 5.1. Кінематика 5.1.10. Швидкість Швидкість – векторна величина, яка дорівнює відношенню переміщення точки за будь-який інтервал часу до значення цього інтервалу. Вона характеризує швидкоплинність будь-якого процесу. При рівномірному русі вона чисельно дорівнює відношенню пройденого шляху s до проміжку часу t, за який цей шлях пройдено Вектор швидкості спрямований по дотичній до траєкторії. Швидкість […]...
- Каталіз і каталізатори – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Каталіз і каталізатори Існують речовини, які здатні самою своєю присутністю в реактивній суміші змінювати швидкість хімічної реакції. Причому ці речовини в ході реакції самі не змінюються. Такі речовини називають каталізаторами, а саме явище зміни швидкості реакції в […]...
- ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням На значення ΔG великий вплив має температура. Цей вплив визначається знаком і величиною ΔS. При ΔS > 0 з підвищенням температури (збільшенням Т) негативне значення ΔG буде зменшуватися, а при ΔS < 0 – збільшуватися. Приклад реакції, […]...