Водневий зв’язок – Йонний, металічний і водневий зв’язки
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.7. Йонний, металічний і водневий зв’язки
3.7.3. Водневий зв’язок
Низка сполук з полярним Ковалейтним зв’язком, які містять Гідроген і елемент з високою електронегативністю (найчастіше Оксиген, Флуор, Нітроген), утворюють так званий водневий зв’язок (позначають “—“). Це різновид невалентного міжмолекулярного зв’язку (вандерваальсового1), який виникає між атомами Гідрогену однієї молекули
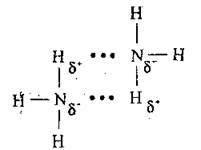
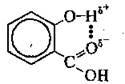
Якщо такий зв’язок утворюється між однаковими молекулами, його називають симетричним-, якщо між різними (розчин аміаку у воді)- несиметричним. Водневий зв’язок може також виникати між окремими групами атомів усередині молекули. Тоді його називають внугрішньомолекулярним водневим зв’язком. Наприклад, у молекулі саліцилової кислоти він виникає між карбоксильною
Інколи завдяки утворенню водневих зв’язків формуються доволі стійкі комплекси, які не руйнуються при нагріванні таї існують навіть у парах. Це, наприклад, димери мурашиної кислоти:
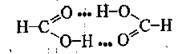
Водневий зв’язок значно впливає на фізичні та хімічні властивості органічних сполук, полімерів, білків і нуклеїнових кислот. За властивості білка чи нуклеїнової кислоти відповідає просторова конфігурація молекул, яку фіксують водневі зв’язки. Постійні розриви і відновлення водневих зв’язків в організмі – важлива частина процесу обміну речовин.
Related posts:
- Йонний зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.1. Йонний зв’язок Якщо різниця електронегативностей пари атомів, що утворюють зв’язок, > 1,7 (за Полінгом), між ними утворюється йонний зв’язок. Зазвичай йонний зв’язок утворюється між металічними і неметалічними елементами. Атоми металічних елементів віддають електрони […]...
- Металічний зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.2. Металічний зв’язок У речовинах, які утворені металічними хімічними елементами, між атомами виникає металічний зв’язок. Як відомо, атоми металів відносно легко віддають валентні електрони, внаслідок чого утворюються позитивно заряджені йони. Такий процес відбувається не […]...
- Будова молекули води. Водневий зв’язок між молекулами води ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.4. Будова молекули води. Водневий зв’язок між молекулами води У молекулі води є два ковалентні полярні зв’язки між атомом Оксигену і двома атомами Гідрогену. Через велику різницю електронегативності Оксигену (3,5) і Гідрогену (2,2) електронні хмари зміщені в бік Оксигену, […]...
- Водневий зв’язок Хімія Загальна хімія Хімічний зв’язок Водневий зв’язок Водневий зв’язок – це зв’язок між позитивно зарядженим атомом Гідрогену однієї молекули і негативно зарядженим атомом іншої молекули. Водневий зв’язок має частково електростатичний, частково донорно-акцепторний характер....
- Водневий зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.4 . Водневий зв’язок У молекулах атоми Гідрогену крім електронної пари не мають інших електронів. Ядро атома Гідрогену (протон) дуже мале, тому густина позитивного заряду дуже велика. Якщо атоми Гідрогену утворюють молекули з найбільш електронегативними атомами, то зв’язуюча електронна пара значно відтягнута від протонів. Тому на зовнішнє оточення […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Тема 1 РОЗЧИНИ Урок 4 Тема уроку. Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Цілі уроку: формувати уявлення учнів про склад розчинів; ознайомити з властивостями води як універсального розчинника; розвивати знання про хімічний зв’язок і будову речовини на прикладі будови молекули води й поняття про […]...
- Дисоціація води. Водневий показник ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.8. Дисоціація води. Водневий показник Хімічно чиста вода дуже слабо проводить електричний струм. Провідність зумовлена дисоціацією: За температури 25 °С ступінь дисоціації води а = 1,8 · 10-9. Оскільки 1 л води (1000 г) містить 55,56 моль речовини, концентрації […]...
- ЯКІ ЗВЯЗКИ ІСНУЮТЬ МІЖ НЕЖИВОЮ І ЖИВОЮ ПРИРОДОЮ? МАНДРІВКА ПЕРША ПРИРОДА ВОСЕНИ Зустріч 26. ЯКІ ЗВЯЗКИ ІСНУЮТЬ МІЖ НЕЖИВОЮ І ЖИВОЮ ПРИРОДОЮ? Ти дізнаєшся про взаємозв’язки між неживою природою, рослинами і тваринами. Пригадай! Як змінюється полуднева висота Сонця восени? Як це впливає на тривалість дня та температуру повітря? Розкажи Сонечку Семикрапочці. Як зміни в неживій природі впливають на рослини і тварин? Працюємо разом […]...
- Водневий показник розчинів солей – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.4. Водневий показник розчинів солей Багато сольових розчинів мають нейтральне середовище, деякі – кисле або лужне. За Бренстедом, вода при цьому виконує функцію основи або кислоти. Приклад. Натрій хлорид Іон Na+: не вступає в реакцію з водою. Іон Сl-: надзвичайно слабка основа, тому протоліз не відбувається. Розчин натрій хлориду […]...
- Аміак – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.3. Аміак Будова молекули. Нітроген утворює з гідрогеном кілька сполук, з яких найважливішою є аміак. Електронна формула молекули аміаку така: Видно, що з чотирьох електронних пар у нітрогену – три спільні (зв’язуючі) і одна неподілена (незв’язуюча). Будову […]...
- Йонний зв’язок Хімія Загальна хімія Хімічний зв’язок Йонний зв’язок Йонний зв’язок – це зв’язок, зумовлений електростатичним тяжінням між різнойменно зарядженими йонами. Під час утворення йонного зв’язку один з атомів віддає електрон, перетворюючись на позитивно заряджений іон – катіоН, а інший приймає електрон, перетворюючись на негативно заряджений іон – аніоН. Різниця між електронегативностями атомів, які утворюють йонний зв’язок, […]...
- Структура протеїнів – Протеїни (білки) КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 9. Протеїни (білки) 9.3 . Структура протеїнів Протеїни, тобто ланцюги з більше 100 сполучених між собою амінокислот, мають впорядковані тривимірні структури. Ця структура визначає зрештою хімічні властивості протеїну. Існує величезна кількість різних білків. Це пояснюється такими причинами: – різні види білків містять багато залишків різних амінокислот; – довжина ланцюгів молекул різних білків […]...
- Агрегатний стан, розчинність – Властивості карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.3. Властивості карбонових кислот Перші представники карбонових кислот (С1-С3) мають різкий специфічний запах, зі збільшенням вуглеводневого радикала (С4-С9) неприємний запах зникає. Агрегатний стан, розчинність Фізичні властивості пов’язані з полярністю карбоксильної групи. Полярність обумовлює утворення водневих зв’язків з молекулами води або іншими молекулами карбонових кислот. – Нижчі члени гомологічного […]...
- Добування амінокислот – АМІНОКИСЛОТИ Й БІЛКИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АМІНОКИСЛОТИ Й БІЛКИ Добування амінокислот Основний спосіб добування амінокислот – заміщення атома галогену на аміногрупу в галогенозамінених кислотах. Цей спосіб аналогічний до добування амінів з алкіл галогенів та аміаку. Галогеноводень, який виділяється при заміщенні, зв’язують надлишком аміаку:...
- Фізичні властивості альдегідів – АЛЬДЕГІДИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АЛЬДЕГІДИ Фізичні властивості альдегідів Альдегіди – безбарвні речовини, з характерним запахом. Перший член гомологічного ряду альдегідів – формальдегід – при звичайних умовах є газоподібною речовиною (на відміну від спиртів). Формула Назва ІUРАС Tпл, °C Tкип, °C Розчинність уводі НСНО Метаналь -92 […]...
- Фізичні властивості спиртів – СПИРТИ Й ФЕНОЛИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ СПИРТИ Й ФЕНОЛИ Фізичні властивості спиртів У гомологічному ряді спиртів немає газоподібних речовин. Перші члени гомологічного ряду – це рідини, а вищі спирти (від С15) – тверді речовини. У гомологічному ряді нормальних спиртів зі збільшенням молекулярної маси збільшуються температури плавлення й […]...
- Ортофосфатна кислота – НІТРОГЕН. ФОСФОР Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ НІТРОГЕН. ФОСФОР Ортофосфатна кислота Схематична будова молекули ортофосфатної кислоти подана нижче. Фізичні властивості ортофосфатної кислоти При нормальних умовах ортофосфатна кислота являє собою безбарвну й розпливчасту на повітрі кристалічну сполуку із температурою плавлення +42 °С (65%-й розчин кислоти замерзає тільки при -85 […]...
- Металічний зв’язок Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Металічний зв’язок Метали мають низку спільних фізичних властивостей: – добру електропровідність; – добру теплопровідність; – металічний блиск; – добру пластичність (ковкість); – зазвичай високу твердість; – як правило, перебувають у твердому агрегатному стані. Такі спільні фізичні властивості металів […]...
- Гідроген пероксид – ОКСИГЕН. СУЛЬФУР Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ОКСИГЕН. СУЛЬФУР Гідроген пероксид Фізичні властивості гідроген пероксиду Між молекулами Н2О2 виникають міцні водневі зв’язки, унаслідок чого речовина являє собою в’язку, важку (ρ = 1,44 г/см3) рідину блідо-голубого кольору з високою температурою кипіння (Тпл = +0,4 °С, Ткип = +150 °С). […]...
- Вода – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.3. Вода Вода – оксид гідрогену – одна з найпоширеніших і найважливіших речовин. Поверхня Землі, вкрита водою, у 2,5 раза більша, ніж поверхня суші. Чистої води у природі немає, – вона завжди містить домішки. Добувають чисту воду […]...
- Спирти. Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв’язок, його вплив на фізичні властивості спиртів II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 29 Тема уроку. Спирти. Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв’язок, його вплив на фізичні властивості спиртів Цілі уроку: формувати уявлення учнів про розмаїтість органічних речовин на прикладі оксигеновмісних органічних сполук; розширити поняття “функціональна група” на прикладі гідроксильної групи спиртів; формувати знання учнів про […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- Вандерваальсова взаємодія (сила) – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.5 . Вандерваальсова взаємодія (сила)1 Водневі зв’язки обумовлені постійною наявністю диполів, вандерваальсові сили виникають при взаємодії короткочасно утворених диполів. Вандерваальсовий зв’язок – найслабший з усіх типів зв’язку. Короткочасний асиметричний розподіл зарядів є тимчасовим диполем. Цей диполь може поляризувати сусідні молекули і тим самим індукувати (лат. inducere – вводити) […]...
- Властивості спиртів – Спирти КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 3. Спирти, феноли й етери Властивості спиртів Молекули спиртів містять, як мінімум, одну гідроксогрупу, яка визначає найважливіші властивості спиртів. Запам’ятайте: групу, що визначає властивості органічної сполуки, називають функціональною групою. Функціональна гідроксогрупа спиртів визначає їхні фізичні властивості, оскільки вона викликає утворення водневих місткових зв’язків, таких як зв’язки між молекулами води. Найважливіші фізичні властивості […]...
- Аміак – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.3. Аміак Аміак (амоніак) – одна з найважливіших сполук Нітрогену. Молекула з чотирма гібридизованими sр3-орбіталями має форму майже правильного тетраедра, валентні кути (H-N-H) – 107,8°. У центрі розташований атом Нітрогену, вершину утворює […]...
- ОКСИДИ НІТРОГЕНУ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ОКСИДИ НІТРОГЕНУ Позитивну валентність Нітроген виявляє у сполуках з Оксигеном – оксидах. При цьому особливістю Нітрогену є те, що він утворює оксиди, які відповідають усім теоретично можливим валентностям від 1 до 5 (зовнішній енергетичний рівень атома Нітрогену містить п’ять електронів). Відповідно існують наступні оксиди нітрогену: N2O, NO, N2O3, […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- Поняття про карбонові кислоти Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ КАРБОНОВІ КИСЛОТИ Поняття про карбонові кислоти Оскільки органічні кислоти, так само, як і решта органічних сполук, мають у своєму складі вуглеводневий кістяк, то всі органічні кислоти називають карбоновими кислотами. Карбонові кислоти належать до оксигеновмісних органічних сполук і мають у своєму складі […]...