Головна ⇒ 📌ГДЗ з Хімії ⇒ Вправа 215-220
Вправа 215-220
№ 215.
Ланки колообігу води в природі:
– випаровування;
– конденсація;
– дощові опади;
– участь у фотосинтезі;
– поглинання коренями рослин з грунту.
№ 216.
Технологічні процеси неможливі без води. Вода є:
– розчинником;
– теплоносієм;
– охолоджувачем.
№ 218.
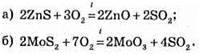
№ 219.
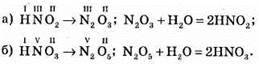
№ 220.
Дано:
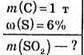
Розв’язання
1. m(С) = 1 т = 1000 кг
2. Визначимо масу Сульфуру вугілля:
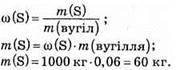
3. Рівняння реакції утворення сульфур(ІV) оксиду:
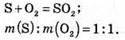
4. Визначимо масу сульфур(ІV) оксиду:
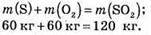
Відповідь: m(SO2) = 120 кг.
Related posts:
- Вправа 195-204 № 195. Відповідь: m(р. р.) = 6 г. № 196. Дано: Розв’язання 1. Обчислимо m розчину: 2. Обчислимо масову частку розчиненої речовини: Відповідь: ω(цукру) = 0,2 або 20 %. № 197. M (р-ну), г M (р. р.), г M (води), г ω(р. р.) 400 8 392 0,02 або 2 % 500 40 460 0,08 або […]...
- Вправа 205-210 № 205. Гідроксиди – сполуки металічних елементів із загальною формулою М(ОН)n (М – металічний елемент). Основи – це гідроксиди Натрію, Калію, Барію, кальцію, інших металічних елементів. Луги – це розчинні у воді основи. № 206. № 207. № 208. Відповідь: a) 56,3 %; б) 65,3 %. № 209. Дано: Розв’язання 1. Обчислимо масу NaOH: (бо […]...
- Вправа 65-72 № 65. Маса атома – важлива характеристика атома. Відносна атомна маса – маса атома елемента в порівнянні з 1/12 масою атома Карбону. № 67. Запис Аr – відносна атомна маса (а. о. м), Аг – символ елементу Аргону. № 68. Be → Аг = 9. Al → Аr =27. Легший атом Берилію у 3 рази. […]...
- Вправа 139-145 № 139. Хімічне рівняння – це запис хімічної реакції за допомогою формул реагентів і продуктів, який відповідає закону збереження маси речовин. № 140. № 141. № 142. № 143. № 144. № 145. Дано: Розв’язання 1. Запишемо рівняння реакції: Згідно із законом збереження маси речовин під час хімічної реакції, маса речовин, що вступила в реакцію, […]...
- ОБЧИСЛЕННЯ МАСОВОЇ ЧАСТКИ І МАСИ РОЗЧИНЕНОЇ РЕЧОВИНИ В РОЗЧИНІ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА № 1. Масову частку розчиненої речовини в розчині обчислюють за такою формулою: Якщо потрібно збільшити масову частку розчиненої речовини в розчині до розчину додають речовину. № 2. А) Відповідь: ω = 25 %. Б) Відповідь: ω = 20 %. № 3. Відповідь: mсолі = 60 г. № 4. Відповідь: mсолі […]...
- Вправа 20 Вправа 20 1. Дано: ε = 30 В Розв’язання: Згідно із законом ЕРС самоіндукції: Звідси Визначимо значення: Відповідь: індуктивність соленоїда 0,375 Гн. L – ? 2. Дано: L = 2 Гн ε= 20 В Розв’язання: Згідно із законом ЕРС самоіндукції: Звідси: Визначимо значення: Відповідь: швидкість зміни струму в обмотці електромагніту 3. Дано: ?І = 2А […]...
- Вправа 146-152 № 146. Добування кисню у промисловості: 1. З повітря: – охолодження повітря і перетворення його на рідину; – підвищення температури та виділення газу азоту, потім кисню. № 147. Реакції розкладу – це реакції, під час яких із однієї речовини утворюється кілька інших. № 148. № 149. Каталізатор – речовина, яка спричиняє перебіг реакції або прискорює […]...
- Вправа 30 Вправа 30 1. Умова максимуму ?d = k? λ; ?d = 3 мкм. λ1 = 0,75 мкм; Умова максимуму виконується λ2 = 0,6 мкм; Умова максимуму виконується. λ3 = 0,5 мкм; Умова максимуму виконується. λ4 = 0,667 мкм; Умова максимуму не виконується. λ5 = 0,545 мкм; Умова максимуму не виконується. λ6 = 0,461 мкм; Умова […]...
- Вправа 131-138 № 131. А) Кисень – проста речовина Оксигена; Б) вода утворена Гідрогеном і Оксигеном; В) молекула кисню складається із двох атомів Оксигену; Г) у результаті фотосинтезу рослини поглинають вуглекислий газ, а виділяють кисень. № 132. У повітрі найбільше газів: – азот N2 – 78,08 %; – кисень O2 – 20,95 %. № 133. Атоми Оксигену […]...
- Розрахунки за хімічними рівняннями Хімія Загальна хімія Основні поняття, закони й теорії хімії Розрахунки за хімічними рівняннями Розрахунок кількості речовини реагентів і продуктів реакції Задача. Яка кількість речовини водню вступить у реакцію з 2 моль азоту? Яка кількість речовини амоніаку при цьому утвориться? Розв’язання 1) Записуємо рівняння реакції, зрівнюємо його: . 2) Коефіцієнти в даному рівнянні показують співвідношення кількості […]...
- Приклади розв’язування типових задач – Урок 8 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Обчисліть масову частку калій гідроксиду (%) в розчині, одержаному при розчиненні 0,75 моль калій оксиду в 180 мл води. Дано: Розв’язання 1. Складемо рівняння реакції і, склавши пропорцію, розрахуємо кількість речовини лугу n(КОН), […]...
- КІЛЬКІСНИЙ СКЛАД РОЗЧИНУ. МАСОВА ЧАСТКА РОЗЧИНЕНОЇ РЕЧОВИНИ № 1. Масова частка розчиненої речовини (ω) – це відношення маси розчиненої речовини mрозчиненої речовини до загальної маси розчину mрозчину, яка складається з маси розчиненої речовини і маси розчинника. Масову частку обчислюють у частках від одиниці та у відсотках. № 2. Щоб визначити масову частку розчиненої речовини в розчині слід скористатися для цього такою формулою: […]...
- ВИГОТОВЛЕННЯ РОЗЧИНУ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА ЛАБОРАТОРНИЙ ДОСЛІД 5 Виготовлення водних розчинів із заданими масовими частками розчинених речовин Речовини та обладнання: терези, аркуш паперу, мірна посудина, 2 хімічні стакани на 250 мл, мірна ложечка для набирання сипучих речовин, скляна паличка, цукор, дистильована вода. Розрахунки. Завдання 1. Виготовити розчин цукру масою 50 г з масовою часткою розчиненої […]...
- Вправа 31 Вправа 31 1. Дано: λ1= 400 нм = = 4 · 10-7 м λ2 =760 нм = = 760 · 10-9 м С = З 108 м/с А = 6,626 · 10-34 Джс Розв’язання: Обчислимо значення: Відповідь: 5 ? 10-19 Дж; 2,6 · 10-19 Дж; 1,66 ? 10-27 кг(м/с); 8,7 ? 10-28 кг(м/с); 5,5 ? […]...
- Вправа 23 Вправа 23 1. Дано: I = 1м G = 10 м/с2 Розв’язання: За формулою періоду математичного маятника Маємо Відповідь: період коливань маятника ≈2 с. Т – ? 2. Дано: Т = 1с G = 10 м/с2 Розв’язання: Звідси Обчислимо значення: Відповідь: довжина маятника 25 см; частота 1 Гц. L – ? V – ? З. […]...
- Вправа 11 Вправа 11 1. Дано: С = 200 мкФ = 2 ? 10-4 Ф?φ = 1000 В Розв’язання: Енергія конденсатора визначається за формулою: Перевіримо одиниці фізичних величин: Підставимо числові значення: Відповідь: енергія конденсатора 100 Дж. W – ? 2. Дано: Q = 4,8 ? 10-3 Кл ?φ = 600 В Розв’язання: Енергія конденсатора визначається за формулою: […]...
- Вправа 28 Вправа 28 1. Дано: V = 200 000 км/с = = 2 ? 108 м/с С = 3 ? 108 м/с Розв’язання: Показник заломлення Обчислимо значення: Відповідь: показник заломлення скла 1,5. N – ? 2. Дано: α = 25° V = 2,4 · 105 км/с = = 2,4 · 108 м/с С = 3 ? […]...
- Вправа 115-124 № 115. Масова частка елемента у сполуці обчислюється, якщо відомі маса елемента і відповідна маса сполуки (а). Масова частка елемента – це відношення маси елемента до відповідної маси сполуки. Її виражають або у% , або частках від 1. № 116. Масова частка елемента у простій речовині дорівнює 1. Тому що проста речовина утворена одним хімічним […]...
- Вправа 22 Вправа 22 1. Дано: Т = 1 кг Х = 30 см = 0,3 м G = 10 м/с2 Розв’язання: ω = 2πν = 2 · 3,14 · 1 Гц = 6,28 с-1. Відповідь: період 1 с, частота 1 Гц, колова частота 6,28 с-1 Т – ? V – ? ω – ? 2. Дано: […]...
- Визначення середньої молярної маси суміші газів – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач V. Визначення середньої молярної маси суміші газів Формули і поняття, які використовуються: Де М(суміші) – середня молярна маса суміші газів, М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В, Χ(А), χ(Б), […]...
- Вправа 26 Вправа 26 1. Дано: С; λ1 Розв’язання: За формулою λ – v? Т, маємо λ1 – сТ, λ2 = vТ. Із маємо λ1 = 9λ2; λ1= 9 · vΤ. Отже, сТ = 9 · vΤ, звідси Відповідь: швидкість поширення зменшиться у 9 разів. 2. Дано λ = 500 м T = T V = 3000Гц […]...
- Вправа 106-114 № 106. Відносна молекулярна маса – це відношення маси молекули до 1/12 маси атома Карбону. Її позначають Мr. Її розраховують за хімічною формулою (б). Маса дорівнює сумі відносних мас атомів, які містяться в молекулі. № 107. Найменшу відносну масу має речовина водень: Мr(Н2) = 2 • Аr(Н) = 2 • 1 = 2. № 108. […]...
- СУЛЬФУР – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ СУЛЬФУР Найважливішою сполукою Сульфуру є сульфатна кислота Н2SO4. У якості сировини для виробництва сульфатної кислоти використовуються самородна сірка, а також Сульфур, одержаний при очищенні від його сполук нафти і газу, а ще – сульфіди. Початкова стадія виробництва незалежно від сировини в принципі однакова – випалювання (нагрівання на повітрі): […]...
- Вправа 29 Вправа 29 1. Дано: F = 25 см D = 25 см Розв’язання: За формулою лінзи Відповідь: фокусна відстань лінзи 12,5 см. F – ? 2. Дано: D = 60 см F = 50 см Розв’язання: За формулою лінзи звідси F = 300 см. Відповідь: зображення буде знаходитися на відстані 300 см. F – ? […]...
- Приклади розв’язування типових задач – Урок 6 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. У розчині, маса якого 400 г, міститься 25 г натрій хлориду. Обчисліть масову частку натрій хлориду (%) в розчині. Дано: Розв’язання Відповідь: w(NaCl) = 6,25 %. Задача 2. Натрій гідроксид, маса якого 10 […]...
- Вправа 8 Вправа 8 1. Дано: U =1,5 В Q = 30 нКл = = 3 · 10-8 Кл Розв’язання: Ємність конденсатора дорівнює Перевіримо одиниці фізичних величин: Підставимо числові значення: Відповідь: ємність конденсатора 20 нФ. С – ? 2. Дано: Δφ = 1000 В С = 3 мкФ = = 3 · 10-6 Ф Розв’язання: Ємність конденсатора […]...
- Виявлення Сульфуру – Якісний аналіз – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК Виявлення Сульфуру При нагріванні тіосполук, що містять Сульфур, з натрій гідроксидом утворюється гідроген сульфур, який виявляється за допомогою реакції з іонами Плюмбуму: Утворюється чорний, важкорозчинний плюмбум(ІІ) сульфід....
- Вправа 27 Вправа 27 1. Дано: α = 25° Розв’язання: Із закону відбивання світла β – α = 90° – β. Отже, 2β = 90°” + α; Відповідь: освітити дно криниці можна дзеркалом, яке поставлене під кутом 57,5° до горизонту. β-? 2. Плоске дзеркало має бути заввишки АВ – людина; А1В1 – зображення людини у дзеркалі; точка […]...
- Вправа 12 Вправа 12 1. Дано: ε – 12 В /=2А, U = 10 В Розв’язання: Згідно із законом Ома для ділянки кола: Звідси Згідно із законом Ома для повного кола: Звідси Перевіримо одиниці фізичних величин: Підставимо числові значення: Відповідь: внутрішній опір джерела 1 Ом, опір навантаження 5 Ом. R – ? R – ? 2. Дано: […]...
- Визначення масової та об’ємної часток компонента в суміші – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач IV. Визначення масової та об’ємної часток компонента в суміші Формули і поняття, які використовуються: Де w(X) – масова частка цього компонента в суміші, Φ(Х) – об’ємна частка компонента X в суміші, M(X) – маса […]...