Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи
Тема 3 Вода
& 24. Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи
Опанувавши цю тему, ви зможете:
– розрізняти основи й кислоти як гідрати оксидів;
– наводити приклади гідратів оксидів, утворених оксидами неметалічних і металічних елементів;
– розпізнавати кислоти й основи, розчинні у воді, за допомогою індикаторів;
– складати рівняння реакцій взаємодії води з оксидами, утвореними неметалічними й металічними елементами.
– Назвіть, які речовини утворюються внаслідок згоряння
Взаємодія води з оксидами металічних елементів. Вивчаючи хімічні властивості кисню (& 18), ви ознайомилися з його основною властивістю – підтримувати горіння. Крім того, за участю кисню відбуваються реакції повільного окиснення. Усі вони пов’язані з утворенням складних речовин – оксидів.
– Пригадайте, чи тільки прості речовини, згоряючи, утворюють оксиди.
Звернемося до демонстраційних дослідів і з’ясуємо, як вода проявляє себе щодо оксидів. Уважно спостерігайте за перебігом реакцій.
Дослід 1. У порцелянову чашку насипимо
Відбувається бурхлива взаємодія води з кальцій оксидом, що супроводжується виділенням великої кількості теплоти (рис. 78).
– Про що свідчить виділення теплоти?
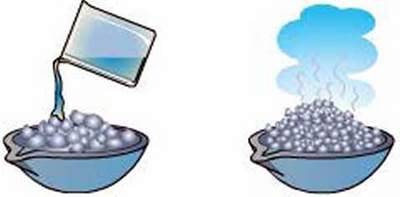
Рис. 78. Взаємодія негашеного вапна з водою
Кальцій оксид унаслідок реакції перетворюється па пухкий білий порошок – гашене вапно (тривіальна назва). Відбулася реакція:
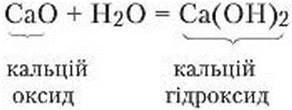
Дослід 2. Дослідження порошку кальцій оксиду на розчинність у воді показало, що він частково розчиняється з утворенням розчину, мильного на дотик. Добутий розчин розілллємо у дві пробірки. До розчину в першій пробірці доллємо розчин фенолфталеїну, до другої – лакмус фіолетовий. Спостереження показують, що забарвлення фенолфталеїну змінилося на малинове, а лакмусу – на синє.
Речовини, що змінюють своє забарвлення під дією лугів або кислот, називають індикаторами.
Ученими досліджено, що зміна забарвлення фенолфталеїну на малинове, а лакмусу – на синє відбувається в лужному середовищі. Отже, унаслідок реакції води з кальцій оксидом утворився гідрат оксиду (сполука оксиду з водою), що виявляє лужні (основні) властивості.
У хімії такі гідрати оксидів називають основами. Відповідно оксиди, які утворюють основи, називають основними.
Подібно до того, як взаємодіє з водою кальцій оксид, реагують натрій оксид, каші оксид та ін. Наприклад:
Na2О + Н2О = 2NaOH
Розчинні у воді основи називають лугами.
Більшість оксидів металічних елементів (FеО, Fe2О3, СrО, Сr2О3, СuО) не реагують з водою, але їм теж відповідають гідрати оксидів.
Взаємодія води з оксидами неметалічних елементів. З реакцією добування фосфор (V) оксиду ви вже ознайомилися під час виконання досліду горіння фосфору.
Дослід 3 (дослід проводять під тягою). Для демонстрації взаємодії фосфор(V) оксиду з водою в хімічну склянку наливають воду, над якою в ложці для спалювання речовин спалюють червоний фосфор. Утворений фосфор(V) оксид взаємодіє з водою. Якщо в добутий розчин додати лакмус, його забарвлення змінюється на червоне. Зміна забарвлення лакмусу свідчить про появу кислого середовища. Отже, фосфор (V) оксид, сполучаючись з водою, утворює кислоту. Рівняння реакції:
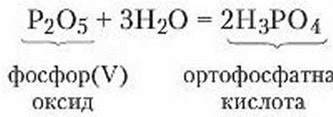
Вода взаємодіє також з іншими оксидами неметалічних елементів: сульфур(VІ) оксидом, карбон(ІV) оксидом, нітроген (V) оксидом. Відповідно утворюються сульфатна H2SO4, карбонатна H2СО3 і нітратна HNO3 кислоти. Наприклад:
СO2 + H2O ⇆ H2CO3
Отже, гідратами оксидів неметалічних елементів є кислоти. Оксиди, яким відповідають кислоти, називають кислотними.
Лабораторний дослід 5
Випробування водних розчинів кислот і лугів індикаторами
– Повторіть правила безпеки під час роботи з лугами та кислотами.
Завдання 1. Hалийте у дві пробірки по 1-2 мл розчинів сульфатної H2SO4 і нітратної HNO3 кислот. У першу пробірку додайте декілька крапель лакмусу, у другу – метилового оранжевого. Опишіть ваші спостереження.
Завдання 2. Hалийте у дві пробірки по 1 -2 мл розчинів кальцій гідроксиду Са(ОН)2 і натрій гідроксиду NaOH У першу пробірку додайте декілька крапань фенолфталеїнy, у другу – метилового оранжевого. Опишіть ваші спостереження.
Зробіть висновок про зміну забарвлення індикаторів у розчинах кислот і лугів. Дані досліджень запишіть у робочий зошит у вигляді таблиці.
Номер Завдання | Що робили? | Що Спостерігали? | Висновок |
Висновок._____________________________________________ .
ПІДСУМОВУЄМО ВИВЧЕНЕ
– Вода – це хімічно активна речовина, яка вступає у взаємодію з оксидами металічних і неметалічних елементів. Унаслідок взаємодії води з оксидами утворюються гідрати відповідних оксидів.
– Оксиди металічних елементів реагують з водою з утворенням гідратів, що називаються основами, а розчинні у воді основи називаються лугами.
– Оксиди неметалічних елементів реагують з водою з утворенням гідратів, що називаються кислотами.
– Кислоти та луги можна розрізняти за зміною забарвлення індикаторів.
ЗАВДАННЯ ДЛЯ КОНТРОЛЮ ЗНАНЬ
1. Уставте пропущені слова, щоб вираз став завершеним.
Основи утворюються внаслідок взаємодії… і… .
Луги змінюють забарвлення фенолфталеїну на… .
2. Напишіть формули гідратів оксидів і відповідних їм оксидів за їх назвами: барій гідроксид, ортофосфатна кислота.
3. Поясніть, як змінять забарвлення розчини індикаторів, якщо їх додати до кожного з гідратів оксидів завдання 2.
4. Напишіть продукти реакцій і поставте коефіцієнти: а) К2O + Н2O = ; б) СO2 + Н2O = .
5. Вам видано розчини натрій гідроксиду та сульфатної кислоти. Поясніть, як експериментально встановити кожну з речовин.
6. У розчин нітратної кислоти масою 140 г, з масовою часткою кислоти 0,4 долили воду об’ємом 260 мл. Обчисліть масову частку кислоти в новому розчині.
7. Вам видано розчини: кальцій гідроксиду, ортофосфатної кислоти й натрій хлориду. Поясніть, як експериментально встановити кожну з речовин.
8. Маринад для маринування помідорів готують за таким рецептом: вода масою 1300 г, натрій хлорид – 60 г, цукор – 80 г і оцет масою 100 г, з масовою часткою оцтової кислоти 5 %. Обчисліть масові частки кожної речовини в такому розчині.