Характеристика хімічних елементів – ОКСИГЕН. СУЛЬФУР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ОКСИГЕН. СУЛЬФУР
Характеристика хімічних елементів
Властивості хімічних елементів
Властивість | Оксиген | Сульфур |
Хімічний символ | 0 | S |
Порядковий номер | 8 | 16 |
Атомна маса | 15,9994 | 32,06 |
Місце в ПС | 2 період; VI група | 3 |
Число електронів на енергетичних рівнях | 2; 6 | 2; 8; 6 |
Радіус атома, нм | 0,066 | 0,104 |
Потенціал іонізації, еВ | 13,618 | 10,36 |
Спорідненість з електроном, еВ | 1,47 | 2,08 |
Відносна електронегативність | 3,5 | 2,6 |
Електронна конфігурація валентного рівня | 2s22p4 | 3s23p4 |
Можливі валентності | II | II, IV, VI |
Можливі ступені окиснення | -2, -1, 0, +1, +2 | -2, 0, +4, +6 |
Ізотопний | 16O – 99,759%; 17O -0,037%; 18O -0,204% | 32S – 95%; 33S – 0,76%; 34S – 4,22%; 36S – 0,014% |
Вміст у земній корі, мол. % | 53 % | 0,03 % |
Елементи Оксиген і Сульфур розташовані в VI групі головної підгрупи. Елементи цієї групи (разом із Селеном Se, Телуром Те та Полонієм Ро) називають також халькогенами (від грец. халькос – мідь та генос – походження), оскільки більшість руд та мінералів містять ці елементи у своєму складі.
Атоми Оксигену здатні проявляти валентність, що дорівнює 2, а для Сульфуру характерна змінна валентність.
Розподіл електронів по орбіталях в атомах Оксигену та Сульфуру схематично показано нижче.
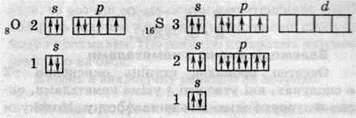
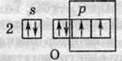
Хімічний зв’язок утворюється в результаті перекривання двох орбіталей, на яких перебуває по одному неспареному електрону. В атома Оксигену таких орбіталей дві, і відповідно валентність Оксигену в цьому випадку дорівнює 2:
У третьому періоді, в якому розташований Сульфур, можливий перехід електронів з р-підрівня на d-підрівень, що дозволяє реалізуватися чотири – та шестивалентному стану.
Чотиривалентний стан Сульфуру:
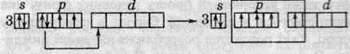
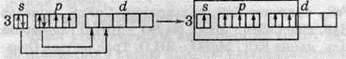
Шестивалентний стан Сульфуру:
Оксиген та Сульфур мають досить високі значення електронегативності, тому в хімічних реакціях вони переважно приймають електрони, тобто проявляють окисні властивості:
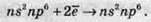
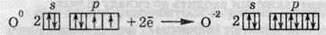
Процес відновлення атома Сульфуру абсолютно аналогічний до наведеного вище процесу для атома Оксигену. З іншого боку, атом Сульфуру, за рахунок більшого радіуса, ніж у Оксигену, також може віддавати електрони, тобто окислюватися, переходячи в стан зі ступенем окиснення +4 або +6.
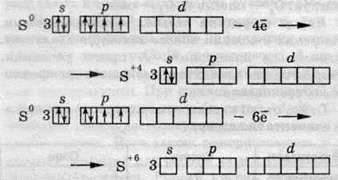
Таким чином, атоми Сульфуру можуть утворювати стани із трьома стійкими ступенями окиснення: -2; +4; +6, на відміну від атомів Оксигену, які можуть проявляти в складних сполуках тільки ступінь окиснення -2.
Поширеність Оксигену та Сульфуру на Землі
Оксисен – найпоширеніший елемент на нашій планеті. З атомів Оксигену складається молекула простої речовини кисню, що міститься в атмосфері Землі у великій кількості (21% за об’ємом). Озон (O3), що перебуває у верхніх шарах атмосфери, так само складається з атомів Оксигену. Вода (Н2O), яка покриває більшу частину поверхні Землі, на 88 % складається з атомів Оксигену. Атоми Оксигену входять до складу великої кількості природних мінералів і становлять майже 47 % маси земної кори. Найпоширенішими з-поміж них є: вапняк СаСO3, пісок SiO2, магнетит Fe3O4, каолін Аl2O3 ∙ 2SiO2 ∙ 2Н2O, піролюзит МnO2, доломіт CaMg(CO3)2, барит BaSO4. Атоми Оксигену входять до складу білків, жирів, вуглеводів та інших молекул, важливих для життя всіх живих істот на Землі.
Сульфур – досить поширений елемент на нашій планеті. Вміст цього елемента в земній корі, за масою, приблизно дорівнює 0,05 %. Елемент Сульфур може утворювати просту речовину сірку, яка зустрічається в південній Європі в самородному стані. Такі родовища розробляли ще давні римляни. Окрім простої речовини, Сульфур входить також до складу багатьох мінералів, таких як пірит FeS2, сфалерит ZnS, халькопірит CuFuS2, кіновар HgS, гіпс CaSO4 ∙ 2Н2O, Na2SO4 ∙ 10Н2O глауберова сіль, каїніт KCl ∙ MgSO4 ∙ 3Н2O. Трапляється Сульфур й у живих організмах: близько 5 % Сульфуру входить до складу рогів, копит та волосся, а в капусті (при перерозрахунку на суху масу) міститься 0,8 % Сульфуру. Сульфур – життєво важливий елемент, адже він входить до складу білків.