Хлор. Фізичні властивості. Добування
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ
§ 19. Хлор. Фізичні властивості. Добування
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати фізичні властивості та способи добування хлору; складати рівняння, схеми електронного балансу відповідних хімічних реакцій.
Хлор уперше добув шведський хімік К. Шеєле (1774). Однак учений помилявся щодо природи добутого газу. У 1810 р. англійський учений Г. Деві висловив думку, що цей газ є простою речовиною. Через два роки французький хімік і фізик Ж.-Л. Гей-Люссак
Фізичні властивості. Хлор складається з двохатомних неполярних молекул, які в твердому стані утворюють молекулярну кристалічну гратку (мал. 24). Тому хлор леткий, неелектропровідний, має низькі температури плавлення і кипіння. За стандартних умов – це газ зеленкувато – жовтого кольору (див. мал. 22, б), отруйний, має різкий запах, який нагадує запах “хлорки”. При охолодженні до -34 °С хлор перетворюється на рідину жовто – зеленкуватого кольору, а при -101 °С переходить у твердий стан. Хлор у 2,5 раза важчий за повітря.

К. Шеєле (1742 –

Ж.-Л. Гей-Люссак (1778 – 1850)
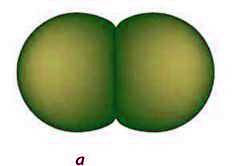
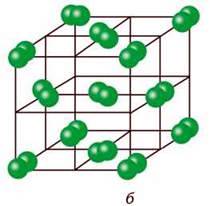
Мал. 24. Моделі молекули (а) та кристалічної гратки (б) хлору
Порівняно з воднем і киснем хлор значно краще розчиняється у воді: за н. у. в 100 об’ємах води розчиняється 460 об’ємів хлору, що пояснюється хімічною взаємодією з водою. Водний розчин хлору називають хлорною водою. Її формула Сl2. Свіжоприготовлена хлорна вода має забарвлення й запах хлору.
Вдихання невеликої кількості хлору спричиняє подразнення дихальних шляхів, а значної – призводить до смерті від задухи. Поводитися з хлором треба дуже обережно і роботи з ним виконувати тільки у витяжній шафі!
При отруєнні хлором слід вдихати пару суміші спирту і 10 %-вого розчину амоніаку (однакових об’ємів).
Добування. У лабораторії хлор звичайно добувають взаємодією концентрованої хлоридної кислоти з манган(IV) оксидом MnO2 при нагріванні (мал. 25):
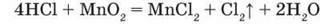
Реакція з калій перманганатом відбуватиметься без нагрівання:
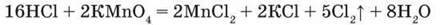
Крім сполук Мангану, для одержання хлору використовують бертолетову сіль КС1О3, плюмбум(IV) оксид РbО2 тощо. Збирають хлор витісненням повітря у посудину дном донизу.
У промисловості хлор добувають електролізом розплаву або концентрованого розчину натрій хлориду:
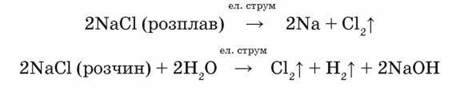

Мал. 25. Добування і збирання хлору
Зріджений (за кімнатної температури під тиском 600 кПа) хлор зберігають у стальних балонах і так доставляють до місця використання.
Коротко про головне
Проста речовина хлор складається з двохатомних молекул, які у твердому стані утворюють молекулярну кристалічну гратку. За стандартних умов це отруйний газ зеленкувато-жовтого кольору, з різким запахом, помірно розчиняється у воді, важчий за повітря, має низькі температури плавлення і кипіння. Розчин хлору у воді називається хлорною водою.
У лабораторії хлор добувають взаємодією концентрованої хлоридної кислоти з сильними окисниками. Основним промисловим способом одержання хлору є електроліз розплаву або концентрованого розчину натрій хлориду. Збирають хлор витісненням повітря у посудину дном донизу.