Значення експериментального методу в хімії
Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 35
Тема. Значення експериментального методу в хімії
Цілі уроку: розвивати навички й уміння розв’язувати експериментальні задачі, використовувати знання про властивості речовин різних класів неорганічних сполук для визначення цих речовин; показати значення експерименту в хімічних дослідженнях; повторити правила техніки безпеки.
Тип уроку: формування знань, умінь і навичок.
Форми роботи: самостійна робота, евристична бесіда, лабораторний експеримент.
Обладнання: Періодична
Демонстрація: індикатори: фенолфталеїн, метиловий оранжевий, лакмус; розчини хлоридної кислоти, натрій хлориду, натрій гідроксиду, аргентум нітрату, барій хлориду, натрій сульфату, натрій карбонату.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
Тестова самостійна робота
Варіант І
Завдання 1. Укажіть серед запропонованих речовин формули солей:
A) Na3PO4;
Б) Сu(ОН)2;
В) Na2SiO3;
Г) H2SiO3.
Завдання 2. Серед наведених хімічних реакцій укажіть
A) Cu + H2SO4
Б) NaCl + H2SO4
В) SO3 + Н2O
Г) K2SO4 + Н2СO3
Завдання 3. Із запропонованих речовин з водою взаємодіють:
A) MgO;
Б) H2SO4;
В) KNO3;
Г) Р2O5.
Завдання 4. Фенолфталеїн забарвить у малиновий колір розчин:
A) CuSO4;
Б) Н3РO4;
В) NaOH;
Г) NaCl.
Завдання 5. Напишіть рівняння реакцій, що дозволяють здійснити перетворення:
ВаО 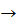 Ва(ОН)2
Ва(ОН)2 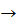 Ва (NO3)2
Ва (NO3)2
Завдання 6. Обчисліть за запропонованою в завданні 5 схемою масу солі, якщо вихідний оксид був узятий кількістю речовини 0,5 моль.
Варіант II
Завдання 1. Укажіть серед запропонованих речовин формули солей:
А) АlСl3;
Б) НСl;
В) Аl(OН)3;
Г) Na2ZnO2.
Завдання 2. Серед наведених хімічних реакцій укажіть ті, у результаті яких можна одержати кислоту:
A) Na2SiO3 + НСl
Б) SiO2 + Н2O
В) Na2SO4 + H2SiO3
Г) SO2 + H2O
Завдання 3. Із запропонованих речовин з водою взаємодіють:
A) HNO3;
Б) Na2O;
В) NaOH;
Г) SO3.
Завдання 4. Фенолфталеїн забарвить у малиновий колір розчин:
A) Na2SO4;
Б) Са(ОН)2;
В) H2SO3;
Г) КВr.
Завдання 5. Напишіть рівняння реакцій, що дозволяють здійснити перетворення:
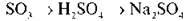
Завдання 6. Обчисліть за запропонованою в завданні 5 схемою масу солі, якщо вихідний оксид був узятий кількістю речовини 1,5 моль.
III. Формування знань, умінь і навичок
Евристична бесіда
У 1666 році в англійському м. Кембридж молодий учений Ісаак Ньютон кілька днів поспіль віддавався дуже дивному заняттю. Він ловив сонячних зайчиків на аркуш паперу. Вікно він щільно закрив ставнями та в одному зі ставень просвердлив маленьку круглу дірку. Через цей отвір уривався в чорний морок вузький пучок сонячних променів. Ньютон походжав кімнатою, підставляючи під промені долоню чи папір або пропускаючи їх аж до стінки. Невже вченому юнакові була приємною ця дитяча забавка? Звичайно ж, ні. Ньютон проводив експеримент.
У його руках була трикутна скляна призма. Коли призма опинялася на шляху променів, зникав круглий білий зайчик, і замість нього з’являлася довга багатобарвна смуга. Хто знає, як називається ця смуга? Ньютон назвав її спектром.
Багато великих відкриттів були зроблені завдяки численним серйозним експериментам учених.
Які закони хімії ми вивчали?
Закон збереження маси М. В. Ломоносова, A. Л. Лавуазьє. Лавуазьє здійснював свої дослідження у власній лабораторії, обладнаній найточнішими фізичними приладами – терезами, термометрами, барометрами, а також апаратами власної конструкції. Лавуазьє був чудовим експериментатором і тонким спостерігачем.
Гемфрі Деві почав займатися хімією як учень аптекаря й так захопився цією наукою, що за короткий час опанував найбагатшими знаннями. Його улюбленим підручником був підручник з хімії Лавуазьє. Юнак ставив сміливі експерименти, описував їх, робив такі висновки, яких не робили досвідчені вчені. І незабаром учений світ заговорив про роботу молодого хіміка.
Сьогодні ми будемо експериментаторами. Ми познайомимося з реакціями, що дозволяють відрізняти одні хімічні речовини від інших. Такі реакції в хімії називаються якісними реакціями.
Лабораторна робота № 10. Розв’язання експериментальних задач
Повторюємо правила роботи з хімічними речовинами, основні правила поведінки в хімічному кабінеті.
Дослід 1
У три пробірки без написів лаборант налив розчини: натрій хлориду, хлоридної кислоти, натрій гідроксиду. Допоможіть недбалому лаборантові розібратися, в якій пробірці міститься кожна з речовин.
Які реактиви можна використати, щоб розпізнати ці речовини?
Індикатори: фенолфталеїн, лакмус, метиловий оранжевий.
Лавуазьє заповів майбутнім експериментаторам:
– намагайтеся робити добре, а не робити багато;
– спрощуйте досліди, наскільки це можливо;
– ніколи не заповнюйте поспішними висновками мовчання фактів.
Тож будемо дотримуватися порад видатного хіміка. Який індикатор раціонально використати в цьому досліді? Той, який дозволить розпізнати всі три речовини. Вибираємо лакмус.
У пробірці з натрій хлоридом лакмус не змінить кольору.
У пробірці з хлоридною кислотою змінює колір на червоний.
У пробірці з лугом колір змінюється на синій.
Завдання. Акуратно з допомогою лакмусового папірця дослідіть запропоновані розчини та приклейте відповідні етикетки на пробірки.
Розглянемо наступні три пробірки. У кожній з них міститься сіль: натрій хлорид, натрій сульфат або натрій карбонат. Щоб розпізнати ці речовини, слід скористатися якісними реакціями.
Дослід 2. Якісна реакція на хлоридну кислоту та її солі
Якісною реакцією на хлоридну кислоту та її солі є дія розчину аргентум(І) нітрату.
Завдання. Налийте в пробірку 1 мл натрій хлориду, додайте одну-дві краплі аргентум(І) нітрату. Що спостерігаєте? Випадіння білого осаду. Процес описується рівнянням реакції:
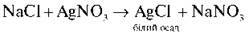
Дослід 3. Якісна реакція на сульфатну кислоту та її солі Якісна реакція на сульфатну кислоту та її солі – дія розчинних солей Барію.
Завдання. Налийте в пробірку 1 мл натрій сульфату, додайте одну-дві краплі барій нітрату. Що спостерігаєте? Випадіння білого осаду. Процес описується рівнянням реакції:
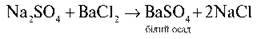
Дослід 4. Якісна реакція на карбонати Якісна реакція на карбонати – дія кислот.
Завдання. Налийте в пробірку 1 мл натрій карбонату, додайте одну-дві краплі хлоридної кислоти. Що спостерігаєте? Виділення бульбашок газу. Процес описується рівнянням реакції:
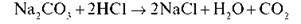
IV. Підбиття підсумків уроку
З допомогою експерименту можна не лише відкривати нові закони, але й визначати вже відомі речовини. За результатами експерименту складемо таблицю.
Речовина | Якісна реакція | Ознаки реакції |
Сульфати | Дія розчинних солей Барію | Білий осад BaSO4 |
Хлориди | Дія аргентум нітрату | Білий осад AgCl |
Карбонати | Дія кислот | Виділення газу СО2 |
Гашене вапно | Білий осад СаСО3 | |
Фосфати | Аргентум нітрат | Жовтий осад Ag3PO4 |
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання, підготуватися до практичної роботи № 2 “Розв’язання експериментальних задач”.