Визначення констант рівноваги – Характеристики хімічної рівноваги
ХІМІЧНА РІВНОВАГА
1. Характеристики хімічної рівноваги
1.3. Визначення констант рівноваги
Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги.
Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до рівняння 2 НІ  Н2 + І2 і закону Авогадро, мають утворитися n(Н2) = 0,11 моль водню і n(І2) = 0,11 моль йоду.
Н2 + І2 і закону Авогадро, мають утворитися n(Н2) = 0,11 моль водню і n(І2) = 0,11 моль йоду.
Ці кількості речовин знаходяться в рівновазі з частиною гідроген йодиду, що залишився, n(НІ) = n0 – n = 1 моль – 0,22 моль = 0,78 моль.
Оскільки в даній реакції при рівновазі кількість речовин залишається постійною, то ці значення можна замінити на концентрації. Для константи рівноваги отримуємо значення:
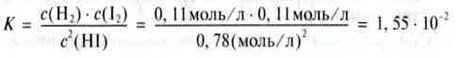




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Реакції рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги Багато хімічних реакцій оборотні. В якому напрямі вони проходитимуть залежить від наявних умов, наприклад, від температури. 1.1. Реакції рівноваги В оборотних реакціях за певних і постійних умов можуть проходити як пряма, так і зворотна реакції. Приклад. Суміш газоподібного йоду і водню реагує при підвищеній температурі, утворюючи гідроген йодид. Н2 […]...
- Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.2 . Константа рівноваги У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції. Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції. Для бімолекулярної реакції типу можна скласти наступні вирази швидкості прямої та зворотної реакції: Коли швидкості обох […]...
- Зміна концентрації – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.3 . Зміна концентрації У випадку зміни концентрації однієї речовини в зрівноваженій системі змінюються концентрації всіх інших речовин. Раніше наголошувалося, що стан рівноваги залежить від температури та тиску, зміна концентрації речовин викличе зміщення рівноваги і система намагатиметься відновити стан рівноваги. В реакції рівноваги А […]...
- Принцип зміщення рівноваги – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.4 . Принцип зміщення рівноваги Усі чинники, що впливають на хімічну рівновагу, можна об’єднати таким чином: Увага: зміна тиску впливає на рівновагу лише в замкнутій системі. Поведінка системи, яка знаходиться в хімічній рівновазі по відношенню до зовнішніх впливів тиску і температури, визначається спільним принципом: […]...
- Зміна тиску – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.2 . Зміна тиску Реакції рівноваги, в яких беруть участь гази, часто супроводжуються зміною кількості частинок. Приклад. При синтезі амоніаку з простих речовин реагують між собою 3 моль водню і 1 моль азоту та утворюється 2 моль амоніаку: 3Н2 + N2 2NH3. Кількість частинок […]...
- СТАН ХІМІЧНОЇ РІВНОВАГИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА СТАН ХІМІЧНОЇ РІВНОВАГИ Умова здійснення хімічної рівноваги: ΔH = ТΔS. За умови хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції. Стан рівноваги характеризує константа рівноваги К. Для системи За значенням константи рівноваги можна робити висновки про глибину протікання реакції: Перша реакція порівняно з другою протікає практично […]...
- ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Якщо система, що знаходиться в рівновазі, піддається зовнішньому впливу, рівновага зміщується у напрямку послаблення цього впливу. Відповідно до принципу Ле Шательє під час нагрівання рівновага зміщується у бік ендотермічної реакції; при підвищенні тиску – у бік реакції, яка проходить зі зменшенням […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ § 22. Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку Усвідомлення змісту цього параграфа дає змогу: розв’язувати задачі на надлишок. Розглянемо рівняння реакції водню з хлором: За яким водень масою 2 г реагує з хлором масою 71 г з утворенням […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Виявлення крохмалю – Виявлення крохмалю і целюлози АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 2 . Визначення властивостей речовин 2.3 . Виявлення крохмалю і целюлози Виявлення крохмалю При додаванні краплі червоно-коричневого розчину йоду-йодиду калію на крохмаль утворюється чорно-синя йодо-крохмальна сполука. Спіральна структура амілози утворює порожнину, що має форму каналу, в яку можуть проникати невеликі молекули йоду. Взаємодія між молекулами йоду і глюкозними кільцями амілози викликає поглинання […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Хімічна рівновага ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.6. Хімічна рівновага Оборотні реакції не доходять до кінця і завершуються встановленням хімічної рівноваги. Наприклад, у реакції синтезу аміаку (див. § 10.4) рівновага настає тоді, коли за одиницю часу утворюється стільки само молекул аміаку, скільки їх […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Лабораторна робота № 9 “Визначення умов рівноваги важеля” РОЗДІЛ III МЕХАНІЧНА РОБОТА. ЕНЕРГІЯ УРОК № 4/38 (із резерву) Тема уроку. Лабораторна робота № 9 “Визначення умов рівноваги важеля” Тип уроку: удосконалювання знань і вмінь. Мета уроку: удосконалювати знання про прості механізми; розвивати навички самостійної дослідницької роботи. План уроку Етапи Час Прийоми і методи I. Інструктаж з техніки безпеки 5 хв. Коментар учителя II. […]...
- УМОВИ І ВИДИ РІВНОВАГИ ТВЕРДОГО ТІЛА – МЕХАНІКА ТВЕРДОГО ТІЛА Фізика підготовка до ЗНО комплексне видання МЕХАНІКА 2. ОСНОВИ ДИНАМІКИ 2.4. МЕХАНІКА ТВЕРДОГО ТІЛА 2.4.2. УМОВИ І ВИДИ РІВНОВАГИ ТВЕРДОГО ТІЛА Загальна умова рівноваги тіла. Для того щоб тіло перебувало в рівновазі, необхідно, щоб дорівнювали нулю геометрична сума прикладених до нього сил і алгебраїчна сума моментів сил відносно можливої осі обертання: Виконання цих умов не […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Визначення – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується. Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції. 2.1. Визначення Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу: ∆n – зміна кількості речовини […]...
- Види рівноваги – Статика 5. Механіка 5.4. Статика 5.4.9. Види рівноваги А) Тіло не має осі обертання. Рівновага тіла стійка, якщо при малому відхиленні від положення рівноваги виникає сила, що повертає тіло в попереднє положення. Рівновага тіла нестійка, якщо при малому відхиленні від положення рівноваги виникає сила, що віддаляє тіло від попереднього положення. Рівновага тіла байдужа, якщо при зміні […]...
- ПОРУШЕННЯ ПРИРОДНОЇ (ЕКОЛОГІЧНОЇ) РІВНОВАГИ Екологія – охорона природи ПОРУШЕННЯ ПРИРОДНОЇ (ЕКОЛОГІЧНОЇ) РІВНОВАГИ – зміни в процесах взаємодії та складі компонентів і елементів екосистеми, що призводять у кінцевому підсумку до її заміни ін. екосистемою на тривалий або умовно безкінечний термін. Напр., вирубування лісів у посушливій зоні може спричинити зміщення прир. балансу в бік розвитку екосистеми пустелі – стійкого (рівноважного, квазістаціонарного) […]...
- Визначення масової та об’ємної часток компонента в суміші – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач IV. Визначення масової та об’ємної часток компонента в суміші Формули і поняття, які використовуються: Де w(X) – масова частка цього компонента в суміші, Φ(Х) – об’ємна частка компонента X в суміші, M(X) – маса […]...
- Схема хімічної реакції. Закон збереження маси речовин під час хімічної реакції. Хімічне рівняння Розділ 2 Кисень 19 Схема хімічної реакції. Закон збереження маси речовин під час хімічної реакції. Хімічне рівняння Матеріал параграфа допоможе вам: > з’ясувати, що таке схема хімічної реакції; > зрозуміти суть закону збереження маси речовин під час хімічної реакції; > навчитися перетворювати схеми реакцій на хімічні рівняння. Схема хімічної реакції. Існує кілька способів запису хімічних […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Визначення молярної маси – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 1.3 . Визначення молярної маси У газах і рідинах, що легко випаровуються, використовують основну залежність, яка полягає в тому, що 1 моль речовини в газоподібному стані за нормальних умов займає об’єм V = 22,4 літра. Зважена порція речовини леткої рідини випаровується, а об’єм газу, який утворився, вимірюють за наявної температури і тиску, […]...
- Моль. Молярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.6. Моль. Молярна маса У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься […]...
- Визначення середньої молярної маси суміші газів – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач V. Визначення середньої молярної маси суміші газів Формули і поняття, які використовуються: Де М(суміші) – середня молярна маса суміші газів, М(А), М(Б), М(В) – молярні маси компонентів суміші А, Б і В, Χ(А), χ(Б), […]...
- Умова рівноваги важеля. Момент сили Мета : дати учням знання про умови, за яких важіль буде зберігати рівновагу; навчити користуватися важелями, розпізнавати та використовувати їх; навчити учнів розраховувати сили на зрівноваженому важелі. Тип уроку : комбінований. Унаочнення : рівновага важеля; співвідношення між силами і плечами сил за умови рівноваги важеля. Обладнання : важіль, важки, динамометр. штатив. Очікувані результати Після уроку […]...
- Проведення титрування – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Проведення титрування Для визначення концентрації кислоти або лугу потрібне таке приладдя: – піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації; – бюретка для вимірювання розчину відомої концентрації; – Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації. Після додавання […]...
- Момент сили. Умова рівноваги тіла, що має вісь обертання ЗАСТОСУВАННЯ ЗАКОНІВ ДИНАМІКИ Урок № 13 Тема. Момент сили. Умова рівноваги тіла, що має вісь обертання Мета: дати учням знання про момент сили і правило моментів: показати, що правило моментів виконується і для тіла, яке має незакріплену вісь обертання; пояснити значення правила моментів у побуті. Тип уроку: комбінований. План уроку Контроль знань 10 хв. 1. […]...
- Лабораторна робота № 11 “Вивчення умови рівноваги важеля” Мета : практично встановити, за якого співвідношення плечей і сил важіль перебуває в рівновазі; розвивати практичні вміння користуватися важелем і здійснювати необхідні вимірювання під час дослідження умов його рівноваги; виховувати дбайливе ставлення до приладів під час проведення експериментів. Тип уроку : урок удосконалення знань, формування експериментальних умінь. Обладнання : шкільний лабораторний важіль, штатив, набір важків […]...
- Принцип Ле Шательє ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.7. Принцип Ле Шательє Напрямок зміщення хімічної рівноваги при зміні концентрації реагуючих речовин, температури і тиску (для газових реакцій) визначається загальним положенням, що відоме під назвою принципу рухомої рівноваги, або принципу Ле Шательє: Якщо на систему, […]...
- МОМЕНТ СИЛИ. УМОВИ РІВНОВАГИ ВАЖЕЛЯ Тип уроку: комбінований урок. Мета: увести поняття рівноваги тіла, стійкості рівноваги, поняття моменту сили; надати учням уявлення про види простих механізмів; з’ясувати умову рівноваги важеля, ознайомити учнів з правилом моментів, показати практичну значущість отриманих знань; розвивати інтерес до вивчення фізики. Обладнання та наочність: демонстрування різних видів рівноваги тіла (моделі, вази з квітами, тринога, іграшки зі […]...
- МОМЕНТ СИЛИ. УМОВИ РІВНОВАГИ ВАЖЕЛЯ Розділ 4 МЕХАНІЧНА РОБОТА ТА ЕНЕРГІЯ &46. МОМЕНТ СИЛИ. УМОВИ РІВНОВАГИ ВАЖЕЛЯ Як уже зазначалося, важіль – тверде тіло, яке може обертатися навколо нерухомої опори. Його застосовують для зміни напряму й значення сили, наприклад для зрівноваження великої сили малою. Важіль (мал. 282) має такі характеристики. Точка прикладання сили – це точка, у якій на важіль […]...
- Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 23 Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; […]...
- Найважливіші характеристики ковалентного зв’язку ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.6. Найважливіші характеристики ковалентного зв’язку Характерні властивості ковалентного зв’язку – кратність, довжина, енергія, насиченість, спрямованість, полярність – визначають фізичні та хімічні властивості сполук. Кратність зв’язку визначається кількістю спільних електронних пар, які зв’язують атоми. Відповідно ковалентний зв’язок буває простим (одинарним), подвійним […]...
- НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Для кількісної характеристики окисно-відновних можливостей речовин, що знаходяться в розчинах або стикаються з ними, використовують електродні (окисно-відновні) потенціали Е. Взаємозв’язок ΔG і Е виражається рівнянням Де n – число молів електронів, переданих у процесі; F = 96 485 […]...
- У чому полягає принцип економічної рівноваги, обгрунтований А. Маршаллом? Історія економічних вчень МАРЖИНАЛІЗМ. СТАНОВЛЕННЯ НЕОКЛАСИЧНОЇ ТРАДИЦІЇ В ЕКОНОМІЧНІЙ ТЕОРІЇ У чому полягає принцип економічної рівноваги, обгрунтований А. Маршаллом? Принцип економічної рівноваги є одним із визначальних положень неокласичної школи. Рівновага в економіці – це відповідність між попитом та пропозицією, між ресурсами і потребами. Через ціновий механізм рівновага встановлюється шляхом або обмеження споживчого попиту, або збільшення […]...