Алкани (парафіни). Загальна формула алканів. Структурна ізомерія. Поняття про конформацію. Систематична номенклатура. Фізичні властивості алканів
І СЕМЕСТР
Тема 2. ВУГЛЕВОДНІ
Урок 8
Тема уроку. Алкани (парафіни). Загальна формула алканів. Структурна ізомерія. Поняття про конформацію. Систематична номенклатура. Фізичні властивості алканів
Цілі уроку: формувати в учнів знання про гомологію, гомологічні ряди на прикладі алканів; ознайомити учнів з номенклатурою алканів за міжнародною номенклатурою IUPAC; розвивати навички й уміння складати структурні формули й називати органічні сполуки на прикладі алканів, називати насичені вуглеводні за структурною формулою та складати
Тип уроку: вивчення нового матеріалу.
Форми роботи: фронтальна робота, навчальна лекція, демонстраційний експеримент.
Лабораторний дослід 1. Виготовлення моделей молекул вуглеводнів (ізомерів, конформерів).
Демонстрація 1. Визначення якісного складу метану за продуктами горіння.
Демонстрація 2. Моделі молекул вуглеводнів.
Обладнання: медіа-фрагмент про
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
Евристична бесіда
1) Назвіть причину використання метану як палива.
2) Чому число атомів Гідрогену в молекулах вуглеводнів парне?
3) Які ланцюги можуть утворювати між собою атоми Карбону?
4) Серед написаних на дошці речовин укажіть ізомери:
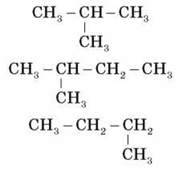
5) Доведіть склад метану експериментальним шляхом.
Демонстрація 1. Горіння парафінів, визначення якісного складу вуглеводнів за продуктами горіння
(Виконується учнями під керівництвом учителя за інструкцією в підручнику.)
1) Окиснення парафіну в присутності купрум(ІІ) оксиду.
2) Як можна довести наявність у продуктах окиснення вуглекислого газу? (Дія на вапняну воду – вапняна вода каламутніє.)
3) Як можна довести наявність у продуктах окиснення води? (Безводний купрум(ІІ) сульфат у результаті утворення кристалогідрату змінює колір з білого на блакитний.)
4) Запишіть рівняння реакції:
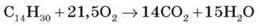
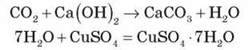
За продуктами горіння можна визначити і якісний, і кількісний склад сполук. Розгляньмо це на прикладі інших вуглеводнів.
III. Вивчення нового матеріалу
1. Гомологи метану. Алкани
Демонстрація 2. Моделі молекул вуглеводнів
Зберемо модель молекули метану CH4.
Тепер подовжимо карбоновий ланцюг на один атом Карбону й необхідне число атомів Гідрогену. Що змінилося?
Аналогічно подовжимо карбоновий ланцюг на два, на три атоми Карбону.
При цьому вийдуть моделі молекул вуглеводнів, що мають подібну будову, але різну довжину ланцюга. Запишемо їхні молекулярні формули: C2H6, C3H8, C4H10.
Розгляньте отримані молекули.
Чим відрізняються за складом і будовою складені моделі молекул?
Гомологія – це явище існування подібних за будовою і властивостями органічних речовин, що відрізняються на групу – CH2.
Група – CH2 називається гомологічною різницею. Речовини, що подібні за будовою й відрізняються одна від одної на одну або кілька груп – CH2, утворюють гомологічні ряди.
Речовини, що входять до одного гомологічного ряду, називаються гомологами.
До насичених вуглеводнів – алканів (парафінів) – належать сполуки з відкритим ланцюгом, у яких атоми Карбону з’єднані один з одним простими (одинарними) зв’язками, а решта їхніх вільних валентностей насичена атомами Гідрогену. За звичайних умов алкани є мало реакційно-здатними, звідки виникла їхня назва – “парафіни” (від лат. parrum affinis – “малоактивний”).
Члени гомологічного ряду насичених вуглеводнів відповідають загальній формулі CnH2n+2.
Розглянемо таблицю гомологічного ряду алканів з назвами (у підручнику або роздавальному матеріалі). Родоначальником цього гомологічного ряду вважають метан, іноді цей ряд так і називають – гомологічний ряд метану.
Завдання. Для вуглеводню складу C4H10 складіть формули двох найближчих гомологів і можливих ізомерів (записуємо їхні структурні формули на дошці й у зошитах).
2. Ізомерія алканів
Перші три члени гомологічного ряду алканів – метан, етан, пропан – не мають ізомерів. Четвертий член – бутан C4H10, відрізняється тим, що має два ізомери: нормальний бутан з нерозгалуженим карбоновим ланцюгом та ізобутан з розгалуженим ланцюгом.
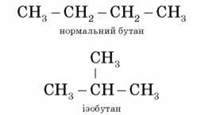
Вид ізомерії, за якого речовини відрізняються одна від одної порядком зв’язку атомів у молекулі, називається структурною ізомерією, або ізомерією карбонового скелета.
Кількість ізомерів зростає зі збільшенням у молекулі вуглеводню числа атомів Карбону. Так, у пентані їх 3, у гексані – 5, у гептані – 9, в октані – 18, у нонані – 35, а в декані C10H22 – уже 75.
Вуглеводневі ланцюги молекул алканів можуть обертатися навколо простих зв’язків, набувати різних геометричних форм і переходити один в одного. Різні геометричні форми молекул, що переходять одна в одну шляхом повороту навколо зв’язків C-C, називаються конформаціями, або поворотними ізомерами (конформерами), а описаний вид ізомерії – конформаційною (поворотною) ізомерією.
Розглянемо на прикладі моделі етану його конформаційну ізомерію.
Оскільки атоми Карбону, зв’язані одинарним?(сигма)-зв’язком, можуть вільно обертатися відносно один одного, для молекули етану можливе нескінченне число різних розташувань атомів Гідрогену в просторі. Ці незакріплені, постійно мінливі розташування атомів у просторі називаються конформаціями.
Конформації відрізняються потенційною енергією, оскільки атоми Гідрогену і зв’язку C – H відштовхуються одне від одного тим сильніше, чим ближче одне до одного вони перебувають. З нескінченного числа конформацій етану можна виокремити дві граничні: ту, що має максимальну енергію, коли атоми Гідрогену біля різних атомів Карбону найбільше наближені один до одного (така конформація називається закритою), і ту, що має мінімальною енергію, коли атоми Гідрогену найбільш віддалені один від одного (така конформація називається загальмованою). Різниця енергій граничних конформацій становить 12 кДж/моль. Ця величина досить велика, щоби стверджувати, що в певний момент часу абсолютна більшість молекул етану перебуває в загальмованій конформації. Водночас ця величина занадто мала, щоб перешкодити обертанню однієї метильної групи відносно іншої.
У більш складних органічних молекулах можлива більша різниця енергій конформацій, і тоді обертання відносно одинарного зв’язку може бути утруднене або взагалі відсутнє.
3. Номенклатура алканів
Учитель нагадує головні принципи міжнародної номенклатури органічних сполук IUPAC.
1. У структурній формулі вуглеводню знаходимо головний ланцюг. Головний ланцюг – це найдовша безперервна послідовність атомів Карбону.
2. Частинки, що не ввійшли в головний ланцюг, – замісники.
3. Головний ланцюг нумерується з того кінця, до якого ближча більшість замісників.
4. В основу назв і головного ланцюга, і замісників покладено корінь, що вказує на кількість атомів Карбону в головному ланцюзі:
C – мет
C2 – ет
C3 – проп
C4 – бут
C5 – пент
C6 – гекс
C7 – гепт
C8 – окт
C9 – нон
C10 – дек
5. У назві головного ланцюга алканів до кореня додається суфікс – ан.
6. У назві вуглеводневих замісників до кореня додається суфікс – ил(-іл).
7. Назва насиченого вуглеводню:
Номер атома головного ланцюга, біля якого є замісник, – назва замісника + назва головного ланцюга + суфікс – ан.
Наприклад:
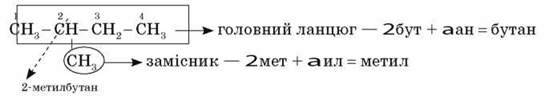
8. Якщо до головного ланцюга приєднані кілька однакових замісників, то в назві цифрою вказується положення кожного замісника, а перед назвою замісника ставиться префікс: ди – (два замісники), три – (три замісники), тетра – (чотири замісники) і т. д.
Наприклад:

Якщо два однакові замісники знаходяться біля одного атома головного ланцюга, то в назві його номер пишеться двічі.
Наприклад:
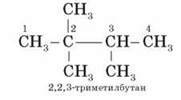
9. Якщо до головного ланцюга приєднані кілька різних замісників, то в назві вони перелічуються за абеткою.
Наприклад:
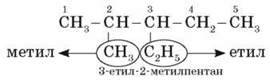
Увага! У цьому випадку важливо уважно перевіряти правильність вибору головного ланцюга.
Наприклад: у сполуці
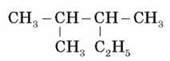
Вибираючи головний ланцюг, потрібно врахувати, що радикал C2H5 містить два атоми Карбону, отже:
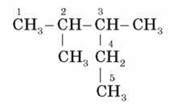
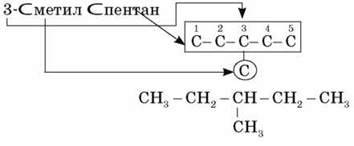
У разі складання структурної формули за назвою спочатку пишеться головний ланцюг, потім він нумерується (у довільному порядку), після цього до головного ланцюга “приєднуються” замісники. На завершення до кожного атома Карбону дописуються атоми Гідрогену (з огляду на те що валентність Карбону – 4).
Наприклад:
IV. Первинне застосування одержаних знань
1. Завдання
На підставі знань про фізичні властивості метану запропонуйте фізичні властивості алканів.
За звичайних умов перші чотири члени гомологічного ряду алканів – гази, C5 – C17 – рідини, а починаючи із C18 – тверді речовини. Температури плавлення й кипіння алканів, їхні густини збільшуються зі зростанням молекулярної маси. Усі алкани легші за воду, у ній не розчиняються, однак розчиняються в неполярних розчинниках (наприклад, у бензені) і самі є чудовими розчинниками.
Фізичні властивості деяких алканів наведено в таблиці.
Фізичні властивості деяких алканів
Назва | Формула | T°пл, °С | T°кип, °С |
Метан | CH4 | -182,5 | -161,5 |
Етан | C2H6 | -182,8 | -88,6 |
Пропан | C3H8 | -187,6 | -42,1 |
Бутан | C4H10 | -138,3 | -0,5 |
Ізобутан | CH3 – CH(CH3) – CH3 | -159,4 | -11,7 |
Пентан | C5H12 | -129,7 | +36,07 |
Ізопентан | (CH3)2CH – CH2 – CH3 | -159,9 | +27,9 |
Неопентан | CH3 – C(СH3)3 | -16,6 | +9,5 |
2. Тренувальні вправи
¦ Дайте назви за номенклатурою IUPAC ізомерам C5H12.
¦ Складіть структурні формули речовин за їхніми назвами:
А) 3-етилгептан;
Б) 2,4-диметилгексан;
В) 2-метил-4-етилгептан;
Г) 3,3-диметил-5-етилоктан.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Додаткове завдання: скласти ізомери гексану, записати їхні структурні формули, дати назви за номенклатурою.
