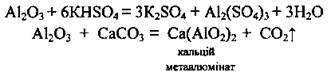Алюміній оксид – Алюміній
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.4. Алюміній
Алюміній – елемент головної підгрупи III групи періодичної таблиці, заряд ядра – +13. Хімічний символ – Аl, відносна атомна маса – 27. Природний алюміній майже повністю складається з єдиного стабільного ізотопу 27Аl зі слідами радіоактивного 26Аl.
Це металічний p-елемент. Найхарактерніший ступінь окиснення – +3, а валентність – III; вони відповідають атому Алюмінію
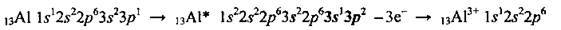
Поширеність у природі
Алюміній – найпоширеніший у природі металічний елемент, за поширеністю серед усіх елементів він посідає четверте місце (після Оксигену, Гідрогену та Силіцію), не трапляється у вільному вигляді. Вміст його в земній корі становить 8,8 %.
Трапляється у вигляді алюмосилікатів, які становлять основну масу земної кори (ортоклаз KAlSi3O8, слюда, нефелін NaAlSiO4, каолін Аl2O3 · 2SiO2 · 2Н2O). Під дією дощів та вуглекислого газу алюмосилікати звітрюються й утворюється глина, основними компонентами якої є каолін, пісок, вапняк та різні оксиди Феруму. До найважливіших
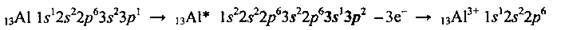 Добування алюмінію
Добування алюмінію
Алюміній одержують електролізом алюміній оксиду Аl2O3 (90%) в розплаві кріоліту Na3AlF6 (10%). Наявність кріоліту приводить до зниження температури плавлення алюміній оксиду до 950 °С:
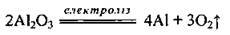
Фізичні властивості алюмінію
Алюміній – це сріблясто-білий метал, легкий, легкоплавкий, має велику пластичність, хорошу тепло – й електропровідність, невисоку твердість. Алюміній вкритий міцною і щільною оксидною плівкою, товщина якої становить 10-8 м.
Хімічні властивості алюмінію
Алюмінію притаманна висока хімічна активність, однак ця активність знижується внаслідок пасивації. Під час хімічних реакцій атом Алюмінію виявляє лише відновні властивості, він легко віддає три електрони і перетворюється на позитивно заряджений йон: 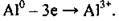
Алюміній взаємодіє:
1) з неметалами:
– легко сполучається з киснем повітря. Утворюється оксидна плівка, яка захищає його від подальшого окиснення:
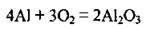
– із сіркою при нагріванні утворює алюміній сульфід (легко розкладається водою):
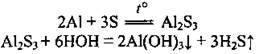
– з вуглецем за доволі високої температури, утворюючи алюміній карбід (також легко розкладається водою):
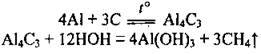
– з азотом за умови сильного нагрівання, утворюючи алюміній нітрид (гідролізується водою):
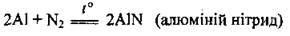
– з галогенами, утворюючи галогеніди:
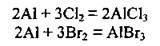
2) зі складними речовинами:
– з водою (після зняття оксидної плівки):
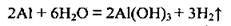
– з аміаком:
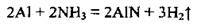
– з кислотами:
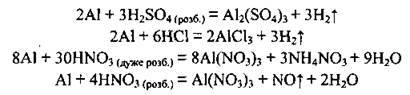
На холоді алюміній не взаємодіє з концентрованими сульфатною та нітратною кислотами. При нагріванні їхня взаємодія можлива:
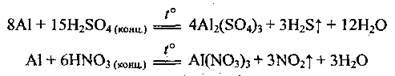
– з оксидами металічних елементів (під час нагрівання):
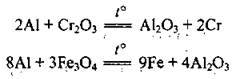
Суміш еквівалентних кількостей Аl і Fe3O4 називають термітом. Процес взаємодії оксидів металічних елементів з алюмінієм за високої температури називають алюмінотермією;
– з лугами. Якщо алюміній помістити у розчин лугу, то спочатку в лузі розчиняється оксидна плівка, а потім відбувається реакція (з утворенням комплексної солі, Склад якої залежить від кількості лугу):

8.4.1. Алюміній оксид
Алюміній оксид – це біла тверда речовина, дуже тверда, з температурою плавлення 2000 °С.
Добування алюміній оксиду
1. Спалювання алюмінію в атмосфері кисню:
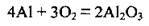
2. Термічний розклад алюміній гідроксиду:
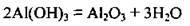
Властивості алюміній оксиду Це амфотерний оксид. У воді не розчиняється. Дише свіжоосаджений алюміній оксид реагує з кислотами і лугами:
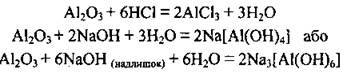
При сплавлянні з лугами утворюються ортоалюмінати (Na3AlO3) або ліетаалюмінати (NaAlO2):
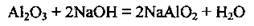
При його сплавлянні з KHSO4, Na2CO3, СаСО3 утворюються хімічно активніші сполуки Алюмінію: