Амоніак – НІТРОГЕН. ФОСФОР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
НІТРОГЕН. ФОСФОР
Амоніак
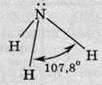
Молекула амоніаку (NH3) являє собою трикутну піраміду, в одній вершині якої перебуває атом Нітрогену, а в інших – атоми Гідрогену. Кут між зв’язками NH дорівнює 107,8°.
Атом Нітрогену в даній сполуці виявляє ступінь окиснення -3.
Атоми зв’язані в молекулу ковалентними полярними зв’язками. Атом Нітрогену в даному разі є акцептором електронів, а атоми Гідрогену –
Фізичні властивості амоніаку
Амоніак являє собою безбарвний газ, із дуже різким характерним запахом. Саме амоніак надає запаху медичному препарату, який називають “нашатирний спирт”. Температури його фазових переходів дорівнюють: Тпл = -78 °С і Ткип = -33 °С. У рідкому стані між молекулами амоніаку утворюються стійкі водневі зв’язки, чим пояснюються високі температури кипіння та плавлення:
Амоніак дуже добре розчиняється у воді: при +20 °С в 1 літрі води
Рідкий амоніак є гарним полярним розчинником. У ньому розчиняються багато іонних сполук, наприклад такі, як NH4I (369 г солі на 100 г амоніаку), NH4Cl (103), AgCl (207).
Окрім води, амоніак розчиняється в спирті, хлороформі, ацетоні та деяких інших розчинниках.
Хімічні властивості амоніаку
Реакції приєднання
Процес утворення водневого зв’язку між атомом Гідрогену молекули води та атомом Нітрогену амоніаку зазвичай на цій стадії не зупиняється, а проходить із утворенням іонів амонію та гідроксид-іонів. Зсув електронної густини зазначений на схемі стрілочкою:
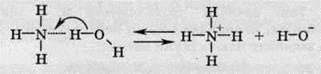
Або в молекулярному вигляді:
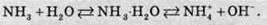
Четвертий зв’язок між Нітрогеном та Гідрогеном в іоні амонію утворюється за донорно-акцепторним механізмом. Іон амонію має форму правильної трикутної піраміди (тетраедра), у вершинах якої перебувають атоми Гідрогену, а в її центрі – атом Нітрогену. При цьому заряд не зосереджений на якому-небудь атомі в молекулі, а рівномірно розподілений між всіма п’ятьма атомами:
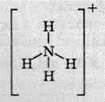
Із наведених вище рівнянь реакцій видно, що розчин амоніаку у воді є основою, тобто генерує гідроксид-іони. Однак записувати цю основу як гідроксид амонію NH4OH не слід, оскільки така сполука не виявлена ані в розчині, ані в кристалічному стані. Її слід записувати як NH3 ∙ Н2О, тому що такі частинки виявлені у водних розчинах.
Константа дисоціації NH3 ∙ Н2О на іон амонію та гідроксид-іон у водному розчині дорівнює 1,77 ∙ 10-5.
Основні властивості амоніаку проявляються в реакціях з кислотами. При цьому утворюються солі амонію:
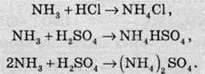
Іон амонію в розчині поводиться так, як іон лужного металу Калію, що можна пояснити подібними розмірами цих іонів.
Солі амонію в сильному лужному середовищі розпадаються, тому що більш сильні основи витісняють із розчину більш слабкі основи:
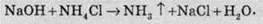
Реакції з металами
Рідкий амоніак за деякими хімічними властивостями схожий на воду. Наприклад, при реакції активного металу з водою виділяється водень і утворюється гідроксид. З іншого боку, при взаємодії того ж активного металу з рідким амоніаком так само виділяється водень й утворюється амід металу:
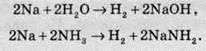
Такі аналогії проявляються й в інших реакціях, наприклад реакції нейтралізації у воді та амоніаку мають такий вигляд:
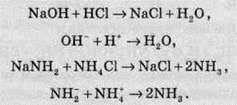
Таким чином, аналогами основ у водних розчинах є аміди металів, а аналогами кислот – солі амонію. Наприклад, сильними кислотами в амоніаку є хлорид і нітрат амонію (NH4Cl та NH4NO3), а сильними основами – аміди Натрію й Калію (NaNH2 та KNH2).
При надлишку металу в рідкому амоніаку утворюються іміди, сполуки, в яких 2 атоми Гідрогену з амоніаку замінені атомами металів:
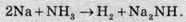
Граничним випадком такого заміщення є нітриди Na3N.
При гідролізі всіх сполук такого типу утворюється луг та амоніак:
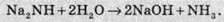
Реакції зі зміною ступеня окиснення
Атом Нітрогену в молекулі амоніаку здатний тільки окислюватися й при цьому виступати в ролі відновника. При високій температурі амоніак згорає в кисні повітря, унаслідок чого утворюється молекулярний азот і вода:
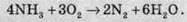
У присутності каталізатора (Pt, Сг2O3) окиснення Нітрогену продовжується, при цьому утворюється нітроген(ІІ) оксид:
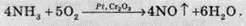
У водних розчинах відновлює бром:
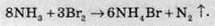
Солі амонію
За рахунок гідролізу розчини солей амонію проявляють слабо-кислу реакцію:
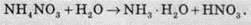
При дії розчинів лугів на солі амонію виділяється амоніак:
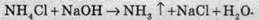
Солі амонію при нагріванні розкладаються за різними механізмами:
Солі амонію використовують у багатьох галузях народного господарства. Це показано в таблиці.
Назва сполуки | Формула сполуки | Сфера застосування |
Амоній нітрат або аміачна селітра | NH4NO3 | Добре нітратне добриво в сільському господарстві, а також при виготовленні різних піротехнічних виробів, наприклад бездимного пороху |
Амоній сульфат | (NH4)2SO4 | Добриво |
Карбонат та гідрогенкарбонат амонію | (NH4)2SO3 та NH4HCO3 | У медицині, в текстильній та харчовій промисловості |
Амоній хлорид | NH4Cl | При виробництві деяких видів гальванічних елементів, при паянні, у текстильній промисловості, у медицині, а також як добриво |
Застосування амоніаку
Амоніак переважно використовують як реагент для виробництва більш складних хімічних сполук, таких як нітратна кислота, сода, різні солі амонію. Багато амоніаку використовують для виробництва різних органічних сполук, що містять атоми Нітрогену. Сьогодні амоніак широко використовують у холодильних установках. Іноді амоніак використовують як рідке добриво.
Якісна реакція на іон амонію
Оскільки майже всі солі амонію добре розчиняються у воді, то для виявлення амоніаку вивчають запах досліджуваного розчину, в який попередньо додають луг. У разі присутності в розчині іонів амонію, при підлуговуванні виділяється амоніак, запах якого легко виявити:
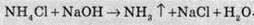
Добування амоніаку
У промисловості амоніак добувають із простих речовин у присутності каталізатора губчатого заліза, платини або вольфрам оксиду W2О5 з добавкою деяких сполук, таких як оксиди Калію К2О, Феруму(ІІІ) Fe2О3, Кальцію СаО та Силіцію SiО2. Для цього каталізатора отрутами є сполуки Сульфуру та оксиди Карбону, тому сировину заздалегідь очищають від таких домішок. Реакція синтезу амоніаку є екзотермічною, тобто в ході реакції виділяється теплота:
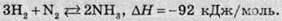
Об’єм суміші в результаті реакції зменшується (реагентів – 4 об’єми, а продуктів – тільки 2). Тоді, за принципом Ле Шательє, для кращого виходу продукту необхідно дотримуватися низької температури та високого тиску. З огляду на це, зазвичай синтез амоніаку проводять при температурі близько +500 °С та тискові 25-35 МПа. Температуру підвищують для того, щоб прискорити реакцію, оскільки при більш низькій температурі рівноважний стан формується впродовж досить тривалого часу.
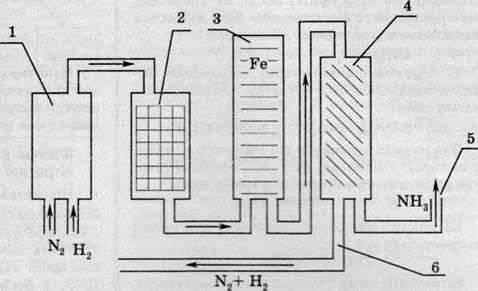
Схема установки для добування амоніаку
Підігріта до потрібної температури суміш азоту й водню стискається до необхідного тиску за допомогою компресора (1). Потім суміш проходить очищення у вугільному фільтрі й масловіддільнику (2) для вилучення слідів вакуумного масла та пилу. Очищена суміш подається в реактор (3), заповнений каталізатором. У результаті такої реакції утворюється близько 30 % амоніаку. Далі суміш амоніаку та непрореагованих азоту й водню надходить у холодильник (4). Оскільки амоніак має досить високу температуру конденсації (-33 °С), порівняно з реагентами, у холодильнику він конденсується й тим самим відокремлюється від реагентів. З виходу (5) надходить рідкий амоніак, а по трубі (6) у систему повертаються реагенти.
Такий циклічний метод використання реагентів забезпечує 95% вихід амоніаку.