Бензен як представник ароматичних вуглеводнів, його склад, хімічна, електронна, просторова будова молекули, фізичні властивості
І СЕМЕСТР
Тема 2. ВУГЛЕВОДНІ
Урок 16
Тема уроку. Бензен як представник ароматичних вуглеводнів, його склад, хімічна, електронна, просторова будова молекули, фізичні властивості
Цілі уроку: ознайомити учнів з бензеном як представником нового гомологічного ряду – аренів, особливостями утворення нового виду зв’язку – ароматичного; формувати уявлення про взаємний вплив атомів у молекулі бензену; розвивати вміння складати структурні формули на прикладі гомологів бензену, ізомерії гомологів бензену; розширити знання про
Тип уроку: вивчення нового матеріалу.
Форми роботи: навчальна лекція, фронтальна робота, демонстраційний експеримент.
Демонстрація 8. Бензен як розчинник.
Обладнання: схема будови молекули бензену, медіафрагмент про будову бензену.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання. Актуалізація опорних знань. Мотивація навчальної діяльності
Фронтальна робота
1) Опишіть, чим відрізняються sp3, sp2, sp-гібридизації.
2) Дайте визначення
3) Визначте формулу вуглеводню, якщо відомо, що в результаті спалювання 1,8 г утворилося 13,44 л вуглекислого газу й 5,4 г води. Зобразіть структурну формулу цього вуглеводню.
Розглядаємо всі варіанти формул, запропонованих учнями.
III. Вивчення нового матеріалу
БЕНЗЕН ЯК ПРЕДСТАВНИК АРОМАТИЧНИХ ВУГЛЕВОДІВ
1. Розповідь учителя
Типовими представниками ароматичних вуглеводнів є похідні бензену, тобто такі карбоциклічні сполуки, у молекулах яких міститься особливе циклічне угруповання із шести атомів Карбону, яке називають бензольним, або ароматичним, ядром.
Загальна формула ароматичних вуглеводнів – CnH2n-6.
Вивчаючи конденсовані залишки світильного газу, який одержували з кам’яного вугілля, М. Фарадей у 1825 р. виділив вуглеводень з температурою кипіння 80 °С і визначив співвідношення Карбону й Гідрогену в ньому як 1:1. У 1834 р. Е. Мітчерлі шляхом нагрівання солей бензойної кислоти одержав подібний вуглеводень і дав йому назву бензин. Згодом Ю. Лібіх запропонував називати цю речовину бензеном.
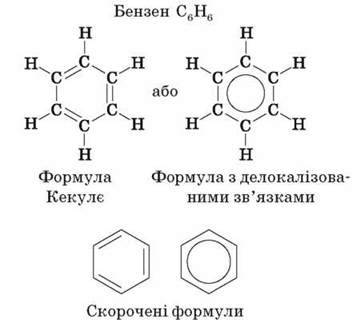
Молекулярна формула бензену – C6H6.
Бензен мав своєрідний запах і виявляв дивні хімічні властивості. Незважаючи на свою “ненасиченість”, бензен важко вступав у реакції приєднання, але легко давав реакції заміщення атомів Гідрогену. Тому бензен та його похідні виокремили в спеціальний клас, який назвали “ароматичні вуглеводні”, або “арени”.
Поширена структурна формула бензену, запропонована в 1865 р. німецьким ученим А. Кекулє, являє собою цикл із подвійними й одинарними зв’язками між атомами Карбону, що чергуються:
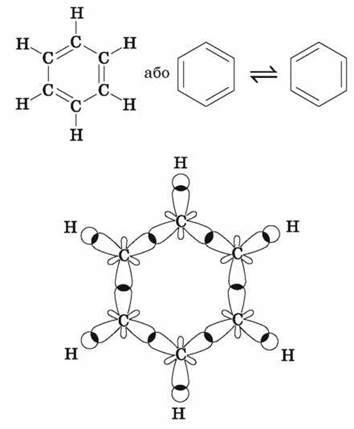
Однак фізичними, хімічними, а також квантово-механічними дослідженнями встановлено, що в молекулі бензену немає звичайних подвійних і одинарних карбон-карбонових зв’язків. Усі ці зв’язки в ньому рівноцінні, еквівалентні, тобто є ніби проміжними “полуторними” зв’язками, характерними виключно для бензольного ароматичного ядра. Крім того, виявилося, що в молекулі бензену всі атоми Карбону й Гідрогену перебувають в одній площині, причому атоми Карбону розташовані у вершинах правильного шестикутника з однаковою довжиною зв’язку між ними, яка дорівнює 0,139 нм, і всі валентні кути становлять 120°. Таке розташування карбонового скелета пов’язане з тим, що всі атоми Карбону в бензольному кільці перебувають у стані sp2-гібридизації. Це означає, що в кожного атома Карбону одна s – і дві р-орбіталі гібридизовані, а одна р-орбіталь – негібридна. Три гібридні орбіталі перекриваються: дві з них – з такими самими орбіталями двох суміжних атомів Карбону, а третя – із s-орбіталлю атома Гідрогену. Подібні перекривання відповідних орбіталей спостерігаються в усіх атомів Карбону бензольного кільця, у результаті чого утворюються дванадцять?-зв’язків, розташованих в одній площині.
Четверта негібридна гантелеподібна р-орбіталь атомів Карбону розташована перпендикулярно площині напрямку?-зв’язків. Вона складається з двох однакових частинок, одна з яких розташована вище, а друга – нижче від згаданої площини. Кожна р-орбіталь зайнята одним електроном. р-орбіталь одного атома Карбону перекривається з р-орбіталлю сусіднього атома Карбону, що приводить, як і у випадку етилену, до спарювання електронів і утворення додаткового п-зв’язку. Однак у випадку бензену перекривання не обмежується лише двома орбіталями, як в етилену: р-орбіталь кожного атома Карбону однаково перекривається з р-орбіталями двох суміжних атомів Карбону. У результаті утворюються дві безперервні електронні хмарини у вигляді торів, одна з яких розташована вище, а друга – нижче від площини атомів (тор – це просторова фігура, що має форму бублика або рятувального кола). Інакше кажучи, шість р-електронів, взаємодіючи між собою, утворюють єдину п-електронну хмарину, що зображується кружечком усередині шестичленного циклу:
З теоретичної точки зору, ароматичними сполуками можуть називатися лише такі циклічні сполуки, що мають плоску будову й містять у замкнутій системі сполучення (4n + 2) р-електронів, де n – ціле число.
Прикладом ароматичних систем із десятьма й чотирнадцятьма р-електронами є представники багатоядерних ароматичних сполук – нафталін 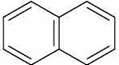 і антрацен
і антрацен 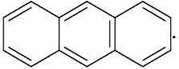
Отже, сучасні дослідження будови молекули бензену показали, що молекула являє собою правильний плоский шестикутник. Усі зв’язки C – C однакові, а їхня довжина не відповідає ні одинарному, ні подвійному зв’язкам. Кути між зв’язками дорівнюють 120°.
Атоми Карбону в молекулі бензену перебувають у стані sp2-гібридизації, кожен атом утворює три?-зв’язки й надає одну р-орбіталь для утворення сполученої системи із шести п-електронів.
Розглядаємо схему будови молекули бензену.
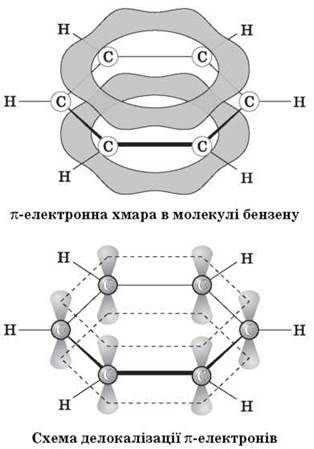
Тому структурну формулу бензену зображують так:
2. Гомологи та ізомерія гомологів бензену
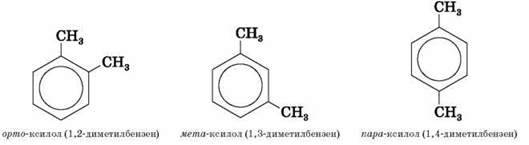
Теорія будови передбачає існування лише однієї сполуки з формулою бензену (C6H6), а також лише одного найближчого гомолога – толуену (C7H8). Однак наступні гомологи можуть уже існувати у вигляді кількох ізомерів. Ізомерія зумовлена ізомерією карбонового скелета наявних радикалів та їхнім взаємним розташуванням у бензольному кільці. Положення двох замісників указують з допомогою префіксів: орто – (о-), якщо вони знаходяться біля сусідніх атомів Карбону (положення 1,2-), мета – (м-) – для відокремлених одним атомом Карбону (1,3-) і пара – (п-) – тих, що містяться один навпроти одного (1,4-).
Наприклад, для диметилбензену (ксилолу):
3. Фізичні властивості бензену та його гомологів
Бензен – безбарвна рідина із запахом, Тпл = 5,5 °С, Ткип = 80 °С, не розчиняється у воді, є чудовим неполярним розчинником.
Його найближчі гомологи – безбарвні рідини зі специфічним запахом. Ароматичні вуглеводні легші від води й у ній не розчиняються, однак добре розчиняються в органічних розчинниках – спирті, ефірі, ацетоні.
Фізичні властивості деяких аренів наведено в таблиці.
Назва | Формула | T°пл, °С | T°кип, °С | D420 |
Бензен | C6H6 | +5,5 | 80,1 | 0,8790 |
Толуен (метилбензен) | С6H5СН3 | -95,0 | 110,6 | 0,8669 |
Етилбензен | С6H5С2Н5 | -95,0 | 136,2 | 0,8670 |
Ксилен (диметилбензен) | С6H4(СН3)2 | |||
Орто- | -25,18 | 144,41 | 0,8802 | |
Мета- | -47,87 | 139,10 | 0,8642 | |
Пара- | 13,26 | 138,35 | 0,8611 | |
Пропілбензен | С6H5(СН2)2CH3 | -99,0 | 159,20 | 0,8610 |
Кумол (ізопропілбензен) | С6H5CH(СН3)2 | -96,0 | 152,39 | 0,8618 |
Стирол (вінілбензен) | С6H5СН = CH2 | -30,6 | 145,2 | 0,9060 |
IV. Підбиття підсумків уроку
1. Застосування бензену та його гомологів.
(Розглядаємо й обговорюємо схему на дошці.)
– Отрутохімікати.
– Розчинники.
– Вибухові речовини.
– Добавки до пального.
– Органічний синтез, наприклад, одержання аніліну, фенолу, стиролу й полістиролу, лікарських препаратів.
2. Складіть формули гомологів бензену складу C8H10 і назвіть їх.
3. Порівняйте будову й фізичні властивості етену, етину й бензену.
Оцінювання роботи учнів на уроці.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.