Будова електронних оболонок атомів. Енергетичні рівні й підрівні
Тема 3
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА
УРОК 47
Тема. Будова електронних оболонок атомів. Енергетичні рівні й підрівні
Цілі уроку: розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I-III періодів; формувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про єдину природу матеріального світу.
Тип уроку: засвоєння
Форми роботи: розповідь учителя, фронтальна бесіда, індивідуальна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
І. Організація класу
II. Актуалізація опорних знань
Фронтальна бесіда
– Як визначити кількість електронів у атомі?
– Чому атоми електронейтральні, адже вони складаються з позитивних протонів, негативних електронів і нейтральних нейтронів?
– Чому говорять, що електрон має двоїсту природу?
– Чи всі електрони в атомі однакові?
– Чим вони відрізняються?
– Що таке орбіталь?
– Які форми
– Яка максимальна кількість електронів може перебувати:
¦ на s-підрівні;
¦ на p-підрівні;
¦ на d-підрівні?
– Як розподіляються електрони в атомі?
– Яка кількість енергетичних рівнів може бути в атомі?
– Як визначити їх кількість за положенням у періодичній системі?
– Як визначити кількість електронів на зовнішньому енергетичному рівні?
– Як розподіляються електрони по енергетичних рівнях?
III. Формування вмінь і навичок
На енергетичних рівнях розташовуються електрони з близьким значенням енергії.
На кожному енергетичному рівні може перебувати суворо визначене число електронів. Максимальна кількість електронів на кожному рівні обчислюється за формулою: N = 2n2.
Разом з учнями заповнюємо таблицю.
Номер рівня | Максимальна кількість електронів | Підрівні |
1 | 2 | S |
2 | 8 | S, p |
3 | 18 | S, p, d |
4 | 32 | S, p, d, f |
5 | 50 | S, p, d, f g |
Можна подати розподіл електронів за енергією у вигляді схеми для перших чотирьох рівнів.
IV. Закріплення. Практика на прикладах
Завдання 1. Побудуйте схему будови атома Гідрогену Н, запишіть електронну формулу, розподіл електронів по квантових комірках.
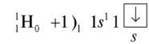
Завдання 2. Побудуйте схему будови атома Гелію Не, запишіть електронну формулу, розподіл електронів по квантових комірках.
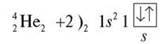
Завдання 3. Побудуйте схему будови атомів елементів II періоду, запишіть електронну формулу, розподіл електронів по квантових комірках.
Біля дошки учні по черзі будують електронні формули Літію, Берилію, Бору, Карбону, далі під керівництвом учителя самостійно будують електронні формули Нітрогену, Оксигену, Флуору, Неону. Учитель під час виконання завдання дає учням індивідуальні консультації.
IV. Підбиття підсумків уроку
Звертаємо увагу учнів на такі ключові моменти складання електронних схем:
1) Загальне число електронів у атомі дорівнює номеру елемента в періодичній системі хімічних елементів.
2) Число енергетичних рівнів у атомі дорівнює номеру періоду, в якому знаходиться елемент.
3) Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, в якій знаходиться хімічний елемент.
4) Заповнення електронами p-підрівня здійснюється відповідно до правила максимального сумарного спіну.
5) Відповідно до принципу Паулі, в атомі не може бути двох однакових електронів. Вони відрізняються розташуванням на енергетичних рівнях за запасами енергії, на підрівнях за формою орбіталі, усередині підрівнів орієнтацією орбіталі в просторі, в одній квантовій комірці можуть розташовуватися тільки два електрони з протилежними спінами.
V. Домашнє завдання
Опрацювати відповідний параграф підручника і відповісти на запитання.
Побудувати схеми будови атомів елементів III періоду, записати електронну формулу, розподіл електронів по квантових комірках.
Творче завдання. Скласти для подальшої роботи таблицю будови електронних оболонок атомів елементів I-III періодів.