D-ЕЛЕМЕНТИ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Хімія – універсальний довідник
ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
D-ЕЛЕМЕНТИ
Більшість хімічних елементів-металів знаходиться у В групах періодичної системи елементів.
Звернемося до її будови. Зі збільшенням заряду ядра атома елемента (атомного номера) відбувається послідовне заповнення електронами атомних орбіталей різних енергетичних рівнів, починаючи з найнижчого.
На 1-ому рівні є одна 1s-АО; вона заповнюється в атомів Н і Не – елементів, які утворюють 1-й період.
На 2-ому рівні є одна 2s – і три 2р-АО; вони заповнюються
На 3-ому рівні розташовуються АО трьох видів: одна Зs-, три 3р – і п’ять 3d-АО. Таким чином, на цьому рівні може розміститися 18 електронів. Однак 3-й період, де заповнюється 3-й енергетичний рівень, закінчується Аргоном, який має на зовнішньому рівні тільки 8 електронів.
У наступного за Аргоном елемента Калію К починає заповнюватися 4-й рівень, і Калій міститься у 4-ому періоді.
Електрон, який додається в атом при зростанні заряду ядра, відчуває, з одного боку, притягання атомним ядром, що змушує електрон займати найнижчий вільний енергетичний рівень,
Саме тому електронна будова Калію така: 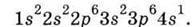 Такий же порядок заповнення АО і рівнів здійснюється у Кальцію.
Такий же порядок заповнення АО і рівнів здійснюється у Кальцію.
Наступне додавання ще одного електрона (у Скандію) зумовлює початок заповнення Зd-АО замість ще більш високих за енергією 4р-АО. Це виявляється енергетично вигіднішим.
Заповнення 3d-Ао закінчується в Цинку, який має електронну будову: 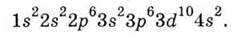
У наступних за цинком елементів відбувається заповнення 4р-АО, і період завершується криптоном, електронна будова якого характеризується вісьмома електронами на зовнішньому рівні: 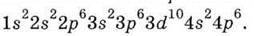
Новий електрон у Рубідію Rb займає 5s-АО 5-ого рівня – починається 5-й період. Розподіл електронів по орбіталях і рівнях в елементів цього періоду відбувається аналогічно, як і в елементів 4-ого періоду.
Таким чином, на відміну від елементів А груп, у яких відбувається поступове заповнення електронами АО зовнішнього рівня, в елементів В груп заповнюються d-АО передостаннього енергетичного рівня. Звідси і назва: d-елементи.
Валентними електронами атомів d-елементів є електрони, які займають d-АО передостаннього і s-АО останнього енергетичних рівнів. Отже, Скандій має три валентних електрони, Титан – чотири і т. д. Це число електронів відповідає номеру групи d-елемента.
Аналогічна ситуація і для елементів А груп, тому елементи А і В груп із рівним числом валентних електронів входять у групу під одним номером.