Добуток розчинності – Рівновага розчинності
ХІМІЧНА РІВНОВАГА
3. Рівновага розчинності
3.2 . Добуток розчинності
Якщо до насиченого розчину солі у воді ще додати цю ж сіль, то ця добавка випаде в нерозчинений осад. Якщо до нього додати сіль, що містить один з іонів розчиненої солі, то утвориться такий самий осад.
Приклад. Якщо до насиченого розчину кальцій сульфату додати трохи кальцій хлориду або натрій сульфату, то в обох випадках утвориться осад кальцій сульфату.

Увага: такі процеси відбуваються і в інших іонних сполуках.
У насиченому
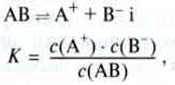
С(АВ) – це концентрація розчиненої солі, яка ще не розпалася на окремі іони. Та оскільки сіль, що перейшла в розчин, практично повністю розпадається на іони, ця концентрація мізерна і стала. Тому концентрацію с(АВ) можна об’єднати з константою рівноваги К у нову константу Крозч.:
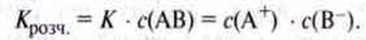
Константа Крозч. є добутком розчинності сполуки іонного типу
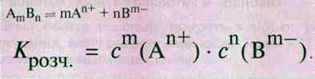
Приклад.
Сполука | Формула | Добуток |
AB | AgCl | Крозч. = с(Ag+) ∙ с(Сl-) |
CaSО4 | Крозч. = с(Са2+) ∙ c(SO42-) | |
АВ2 | Са(ОН)2 | Крозч. = с(Са2+) ∙ c2(ОН-) |
Добуток розчинності залежить від температури і характеризує розчинність солі.
Приклад. Добуток розчинності кальцій сульфату при 25 °С складає
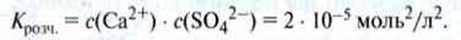
Оскільки в розчині є однакова кількість позитивних і негативних іонів, то с(Са2+) = c(SO42-).
Ця концентрація відповідає також кількості розчиненого у воді кальцій сульфату c(CaSO4). Отже, в насиченому розчині міститься
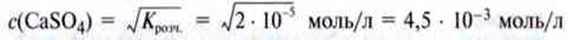
Кальцій сульфату.
Добуток розчинності в насиченому розчині солі при певній температурі завжди постійний.
Приклад. Концентрація іонів Кальцію і сульфат-іонів у насиченому розчині кальцій сульфату складає с(Са2+) = c(SО42-) = 4,5 ∙ 10-3 моль/л. При десятиразовому підвищенні концентрації с(Са2+) шляхом додавання розчину кальцій хлориду концентрація c(SО42-) у розчині знижується вдесятеро; 90 % іонів сульфату, що були розчинені до того, випадають в осад у вигляді твердого кальцій сульфату.
Related posts:
- Залежність розчинності від температури – Рівновага розчинності ХІМІЧНА РІВНОВАГА 3. Рівновага розчинності Багато іонних речовин – наприклад, кухонна сіль – добре розчиняються у воді. Розчинність цих речовин однак обмежена: починаючи з певної кількості, речовина більше не може розчинятися, залишаючись у нерозчиненому стані в насиченому розчині. Увага: частка речовини в насиченому розчині, тобто її концентрація, не залежить від кількості нерозчиненого осаду. 3.1. Залежність […]...
- Іонний добуток води – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага Рівновага, яка виникає в процесі протолізу, залежить від температури, хімічної природи реагентів і зміщується в бік утворення стійкіших сполук. 2.1. Іонний добуток води Молекула води, згідно теорії Бренстеда, може виступати як кислота або як основа. І навіть у чистій воді відбувається так званий автопротоліз (грец. autos – сам): Проте […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Добуток розчинності при 25 °С – Розчини ДОДАТОК 4 . Розчини Добуток розчинності при 25 °С1 Речовина ДР Речовина ДР Речовина ДР AgBr 5 ∙ 10-13 AgCl 2 ∙ 10-10 AgJ 8 ∙ 10-17 Ag2S 6 ∙ 10-50 BaCO2 5 ∙ 10-9 BaSO4 1 ∙ 10-10 CaCO3 5 ∙ 10-9 CaF2 3 ∙ 10-11 Ca(OH)2 4 ∙ 10-6 CaSO4 2 ∙ 10-5 […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Значення pH буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Суміш слабкої кислоти і зв’язаної основи, або слабкої основи і її зв’язаної кислоти характеризується тим, що її водневий показник при додаванні не дуже великої кількості іонів гідроксонію або гідроксид-іонів практично не змінюється. Розчини, показник pH яких по відношенню до кислот і лугів залишається стабільним, називають буферними […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- Проба розчином Фелінга – Виявлення альдегідів АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 2 . Визначення властивостей речовин 2.2. Виявлення альдегідів Альдегіди в лужному розчині є сильними відновниками. При цьому карбонільна група окислюється в карбоксильну групу. Відновлення відповідних іонів металів є доказом наявності альдегідів. Проба розчином Фелінга Як реагент використовують розчин купрум(ІІ) сульфату. Іони Си(ІІ), що містяться в ньому, вступають у реакцію в лужному розчині […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...
- Водневий показник розчинів солей – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.4. Водневий показник розчинів солей Багато сольових розчинів мають нейтральне середовище, деякі – кисле або лужне. За Бренстедом, вода при цьому виконує функцію основи або кислоти. Приклад. Натрій хлорид Іон Na+: не вступає в реакцію з водою. Іон Сl-: надзвичайно слабка основа, тому протоліз не відбувається. Розчин натрій хлориду […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- Таблиця розчинності кислот, основ та солей у воді ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 3 Таблиця розчинності кислот, основ та солей у воді...
- Хімічна рівновага ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.6. Хімічна рівновага Оборотні реакції не доходять до кінця і завершуються встановленням хімічної рівноваги. Наприклад, у реакції синтезу аміаку (див. § 10.4) рівновага настає тоді, коли за одиницю часу утворюється стільки само молекул аміаку, скільки їх […]...
- ІОНІЗАЦІЯ ВОДИ. ІОННИЙ ДОБУТОК ВОДИ. КОНСТАНТА ІОНІЗАЦІЇ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА ІОНІЗАЦІЯ ВОДИ. ІОННИЙ ДОБУТОК ВОДИ. КОНСТАНТА ІОНІЗАЦІЇ ВОДИ Іонний добуток води: Водневий показник Нейтральне середовище: Кисле середовище: Лужне середовище: Нижче наведена шкала взаємозв’язку pH і...
- ГІДРОЛІЗ СОЛЕЙ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ ГІДРОЛІЗ СОЛЕЙ У нейтральних розчинах, тобто за відсутності кислот і лугів, у результаті дисоціації (дуже слабкої) води утворюються однакові кількості іонів Н+ і ОН-: Додавання до води кислоти збільшує концентрацію іонів Н+ і, зміщуючи рівновагу дисоціації води вліво, знижує концентрацію іонів ОН-. Отже, кислий розчин містить більше […]...
- Розчинність речовин у воді – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.2. Розчинність речовин у воді Розчинність – це властивість речовини розчинятися у воді або іншому розчиннику. У воді можуть розчинятися тверді, рідкі й газуваті речовини. За розчинністю у воді всі речовини поділяються на три групи: […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- РІВНОВАГА ПРИРОДНА Екологія – охорона природи РІВНОВАГА ПРИРОДНА – первинна екол. рівновага, створена на основі балансу незмінних або мало змінених діяльністю людини компонентів, що формують середовище, і прир. процесів. Р. п. – одна з найважливіших ознак живих систем, здатність цих систем розвиватися з досягненням клімаксу в ході сукцесії, що є достовірним індикатором Р. п....
- Рівновага тіла – Статика 5. Механіка 5.4. Статика 5.4.8. Рівновага тіла Рівновага тіла – це стан тіла, при якому геометрична сума прикладених до нього сил і геометрична сума моментів цих сил відносно будь-якої точки дорівнюють нулю....
- Приклади розв’язування типових задач – Урок 7 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини Приклади розв’язування типових задач Задача 1. Складіть молекулярне рівняння, що відповідає такому скороченому йонно-молекулярному рівнянню: Розв’язання Йонно-молекулярне рівняння реакції показує, що під час реакції відбулось зв’язування йонів Купруму Сu2+ і сульфід-іонів S2- в нерозчинну сполуку купрум(ІІ) сульфід CuS, тобто […]...
- Тема 12. Електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Тема 12. Електролітична дисоціація Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть речовину, за допомогою якої можна визначити сульфат-іони у розчині: A. Калій перманганат; Б. Лакмус; B. Барій нітрат; Г. Купрум(ІІ) гідроксид. 2. Позначте іони, що знаходяться […]...
- Обчислення масової частки й маси речовини в розчині Тема 1 РОЗЧИНИ Урок 8 Тема уроку. Обчислення масової частки й маси речовини в розчині Цілі уроку: закріпити знання про масову частку розчиненої речовини; формувати навички й уміння обчислювати масову частку розчиненої речовини, застосовувати ці знання для обчислення маси розчиненої речовини, приготування розчинів із заданою масовою часткою розчиненої речовини. Тип уроку: застосування знань, умінь і […]...
- Сполуки заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.7. Сполуки заліза Для заліза найбільш характерні два ряди сполук: сполуки феруму(ІІ) і феруму(ІІІ). Відома також незначна кількість сполук феруму(VІ) – ферати, наприклад ферат калію K3FeO4, ферат барію BaFeO4. Оксид ферум у (II) FeO – чорний […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- ХІМІЧНА РІВНОВАГА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ХІМІЧНА РІВНОВАГА Реакція окиснення діоксиду сульфуру – оборотна. Це означає, що через деякий час після початку реакції в системі встановлюється рівновага: швидкість утворення SО3 дорівнює Швидкості його розкладання на SO2 і O2: За високої температури переважно протікає реакція розкладу (рівновага зміщена вліво), і в рівноважній суміші вміст продукту […]...
- Тема 14. Солі – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Тема 14. Солі Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть речовини, при взаємодії яких одна з одною виділяється осад: A. Купрум(ІІ) гідроксид та натрій гідроксид; Б. Аргентум нітрат та натрій хлорид; B. Кальцій карбонат […]...
- Розчинність. Кристалогідрати – РОЗЧИНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ РОЗЧИНИ Розчинність. Кристалогідрати Розчинність – це властивість речовини розчинятися у воді або в якомусь іншому розчиннику. За розчинністю речовини поділяють на розчинні, малорозчинні й нерозчинні. Однак слід зазначити, що абсолютно нерозчинних речовин не існує. Будь-яка речовина, навіть така як скло чи золото, у […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- Оборотні й необоротні реакції. Хімічна рівновага Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 25 Тема уроку. Оборотні й необоротні реакції. Хімічна рівновага Цілі уроку: формувати уявлення учнів про хімічну рівновагу; ознайомити з класифікацією реакцій на оборотні й необоротні; показати необхідність зсуву хімічної рівноваги; формувати уявлення про фактори, що впливають на зсув хімічної рівноваги. Тип уроку: вивчення нового матеріалу. Форми роботи: фронтальне опитування, самостійна […]...