Фактори, що впливають на швидкість реакції
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ.
§ 4.2. Фактори, що впливають на швидкість реакції
Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – для газових реакцій, від ступеня подрібнення – для твердих речовин, від радіоактивного опромінення).
Вплив концентрацій реагуючих речовин. Щоб
Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин.
Для реакції (I) цей закон виразиться рівнянням
V = kcAcB, (4.2)
Де сA і сB – концентрації речовин А і В, моль/л; k – коефіцієнт пропорційності,
Із рівняння (4.2) неважко встановити фізичний зміст константи швидкості k: вона чисельно дорівнює швидкості реакції, коли концентрації кожної з реагуючих речовин становлять 1 моль/л, або коли добуток їх дорівнює одиниці.
Константа швидкості k залежить від природи реагуючих речовин і від температури, але не залежить від їх концентрацій. Рівняння (4.2), що зв’язує швидкість реакції з концентрацією реагуючих речовин, називається кінетичним рівнянням реакції. Якщо експериментально визначено кінетичне рівняння реакції, то за допомогою його можна обчислити швидкості за інших концентрацій тих самих реагуючих речовин.
Основний закон хімічної кінетики не враховує реагуючих речовин, які перебувають у твердому стані, оскільки їх концентрації стабільні і вони реагують лише на поверхні. Наприклад, для реакції горіння вугілля С + O2 = СО2 кінетичне рівняння реакції має вигляд: v = ксс∙ScO2, де к – константа швидкості реакції; сс – концентрація твердої речовини; S – площа поверхні. Ці величини сталі. Позначивши добуток сталих речовин через к’, матимемо: v = к’сO2, тобто швидкість реакції пропорційна тільки концентрації кисню.
Вплив температури. Залежність швидкості реакції від температури визначається правилом Вант-Гоффа:
З підвищенням температури на кожні 10°С швидкість більшості реакцій зростає в 2-4 рази.
Математично ця залежність виражається співвідношенням:
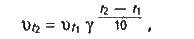 (4.3)
(4.3)
Де, vt1,vt2 – швидкості реакції відповідно при початковій (t1) і кінцевій (t2) температурах; у – температурний коефіцієнт швидкості реакції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури реагуючих речовин на 10°С.
Правило Вант-Гоффа наближене і застосовується лише для орієнтовної оцінки впливу температури на швидкість реакції. Температура впливає на швидкість хімічної реакції, збільшуючи константу швидкості.