Ферум – ДЕЯКІ ПРЕДСТАВНИКИ МЕТАЛІВ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ДЕЯКІ ПРЕДСТАВНИКИ МЕТАЛІВ
Ферум
Властивості хімічного елемента
Ферум належить до металічних елементів. За будовою електронної оболонки його відносять до d-елементів, тому що в нього відбувається заповнення електронами d-підрівня.
Здебільшого Ферум виявляє ступінь окиснення +2 (за рахунок двох електронів зовнішнього рівня) або +3 (віддаючи ще один електрон з передзовнішнього рівня). Ступінь окиснення +3 для Феруму більш стабільний, оскільки
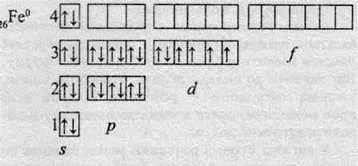
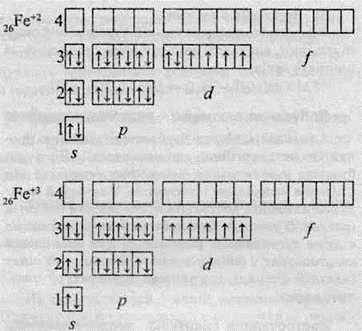
У виняткових випадках Ферум може віддавати шість електронів і виявляє ступінь окиснення +6. Однак такі сполуки, в яких міститься Fе+6, зустрічаються досить рідко.
Ферум є одним з найпоширеніших елементів-металів на Землі. У земній корі 5% маси припадає на атоми Феруму. Тільки Алюмінію в літосфері міститься більше (8,13%).
У природі Ферум зустрічається у вигляді
Ферум входить до складу великої кількості різних мінералів у вигляді оксидів, сульфідів та сполук з іншими елементами. Зазвичай ці речовини розсіяні в земній корі, але зустрічаються й скупчення мінералів. Ці скупчення є джерелом залізної руди, з якої потім добувають залізо.
Сполуки Феруму розчинені у водах деяких мінеральних джерел. Наявність у воді сполук двовалентного Феруму надає їй присмаку металу. Іноді у водопровідній воді, яка тече по старих іржавих трубах, розчинені сполуки тривалентного Феруму, що надає воді кольору іржі.
Атоми Феруму також є складовою частиною багатьох живих організмів: в організмі дорослої людини міститься близько 4-5 г атомів Феруму. Він входить до складу деяких вітамінів, білків, зокрема гемоглобіну – речовини, завдяки якій кров може переносити кисень по організму й виводити вуглекислий газ.
У вигляді простої речовини залізо входить до складу деяких метеоритів. Іноді зустрічаються злитки самородного заліза, хоча більшість учених вважають, що вони теж мають “метеоритне” походження.
Фізичні властивості заліза
Залізо є речовиною з немолекулярною будовою. У звичайних умовах залізо являє собою метал сірого кольору з металічним блиском, добре проводить електричний струм і теплоту. Залізо є досить пластичним металом і добре піддається куванню. Температура плавлення заліза +1540 °С, густина 7,87 г/см3. Як і багато інших металів, залізо не розчиняється у воді та в інших розчинниках, але розчиняється в ртуті.
Залізо притягується магнітом, тобто є парамагнетиком. Для заліза також характерне явище феромагнетизму – воно зберігає намагніченість після усунення зовнішнього магнітного поля. Завдяки цьому із заліза можна виготовляти магніти, а також матеріали для запису інформації.
Хімічні властивості заліза
Залізо досить активно вступає в хімічні взаємодії. Оскільки залізо має явні металічні властивості, то воно вступає переважно в реакції з неметалами.
Залізо активно вступає у взаємодію з киснем навіть у звичайних умовах. При нагріванні заліза на повітрі його поверхня покривається залізною окалиною:

Якщо розжарений залізний дріт помістити в посудину, заповнену чистим киснем, то залізо спалахне, розкидаючи яскраві іскри.
Залізо може активно згорати навіть на повітрі. Однак це можливо тільки тоді, коли залізо подрібнене до дуже дрібного порошку, його називають пірофорним залізом. Якщо такий порошок потрапляє в повітря, то він яскраво спалахує навіть при кімнатній температурі. Подрібнити залізо до дрібного порошку звичайними методами неможливо. Це роблять за допомогою хімічних методів.
Залізний дріт також дуже активно згорає, якщо його помістити в посудину, наповнену хлором. При цьому утворюється ферум(ІІІ) хлорид:

Залізо також активно взаємодіє із сіркою. У результаті цієї реакції утворюється ферум(ІІ) сульфід:
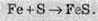
Залізо здатне реагувати з водою. При пропусканні перегрітої пари через розжарені залізні ошурки залізо перетворюється в залізну окалину й при цьому виділяється водень:

У звичайних умовах залізо активно реагує і кислотами. При цьому утворюються солі, до яких Ферум входить зі ступенем окиснення +2:
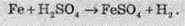
Ферум також здатен витісняти менш активні метали з розчинів солей:
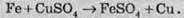
Зі ступенем окиснення +3 він може проявляти амфотерні властивості. Це можна довести тим, що ферум(ІІІ) гідроксид розчиняється в гарячому концентрованому лузі:
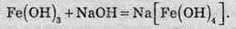
Амфотерні властивості Феруму проявляються значно слабше, ніж в Алюмінію, тому що алюміній гідроксид розчиняється в лугах у звичайних умовах, а ферум(ІІІ) гідроксид – при нагріванні й за умови високої концентрації лугу.
Застосування заліза
Залізо є одним із семи найстаріших металів – металів, відомих людству з давніх часів. Унаслідок високої хімічної активності самородне залізо (тобто у вигляді простої речовини) на Землі не зустрічається. Люди навчилися добувати залізо на початку першого тисячоліття до нашої ери. Звідтоді почався залізний вік розвитку нашої цивілізації. Хоча в археологічних розкопках іноді зустрічаються залізні вироби, датовані другим і третім тисячоліттям до нашої ери, це так зване космічне залізо – уламки залізних метеоритів, які впали на Землю.
Залізо є набагато твердішим металом, аніж мідь, тому знаряддя праці та зброю для полювання було зручніше виготовляти саме з нього. Однак для добування заліза необхідна більш висока температура вогню, ніж для добування міді. І хоча міді в земній корі міститься приблизно в 1000 разів менше, ніж заліза, її було простіше виплавляти й обробляти. Отож першим металом, який почали обробляти люди, була мідь, а не залізо.
Залізо здебільшого використовують у вигляді сплавів: чавуну й сталі. Чавун за фізичними властивостями посутньо відрізняється від заліза: він набагато твердіший і крихкіший. Саме тому чавун не піддається куванню, однак із нього виходять предмети, які можуть витримувати великі механічні навантаження. Раніше з нього виплавляли гармати та ядра й навіть посуд. Зараз із чавуну роблять станини для верстатів, лещата та інші вироби, для яких більше важить механічна міцність, а не пластичність. Такі вироби дуже бояться ударів, від сильного удару чавун розбивається.
Широко розповсюджена іржостійка сталь, її добувають додаванням у сталь нікелю й хрому, а для добування зносостійкої сталі додають марганець (таку сталь використовують для виготовлення залізничних рейок).