Фізичні властивості металів – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
§ 12.2. Фізичні властивості металів
Механічна дія на кристал з ковалентним зв’язком спричиняє зміщення окремих шарів атомів, внаслідок чого зв’язки розриваються і кристал руйнується (рис. 12.1, а). Така сама дія на кристал з металічним зв’язком також спричиняє зміщення шарів атомів, проте завдяки переміщенню електронів по всьому кристалу розриву зв’язків не відбувається (рис. 12.1, б). Для металів
Для всіх металів характерний металічний блиск, звичайно сірий колір і непрозорість, що пов’язано з наявністю вільних електронів.
Той факт, що метали мають хорошу електричну провідність, пояснюється наявністю в них вільних електронів, які під впливом навіть невеликої різниці потенціалів набувають направленого руху від негативного полюса до позитивного.
З підвищенням температури посилюється коливання
До речі, зазначимо, що у неметалів, яким властива провідність, з підвищенням температури електрична провідність зростає, що зумовлено збільшенням числа вільних електронів за рахунок розриву ковалентних зв’язків. При низьких же температурах неметали струм не проводять внаслідок відсутності вільних електронів. В цьому головна відмінність між фізичними властивостями металів і неметалів.
Здебільшого за звичайних умов теплопровідність металів змінюється в такій самій послідовності, як і їх електрична провідність. Теплопровідність зумовлюється високою рухливістю вільних електронів і коливальним рухом атомів, завдяки чому відбувається швидке вирівнювання температури в масі металу. Найбільша теплопровідність – у срібла і міді, найменша – у бісмуту і ртуті.
Різна густина металів. Вона тим менша, чим менша атомна маса елемента-металу і чим більший радіус його атома. Найлегший з металів – літій (густина 0,53 г/см3), найважчий – осмій (густина 22,6 г/см3). Як уже зазначалося, метали з густиною менш як 5 г/см називаються легкими, решта – важкими.
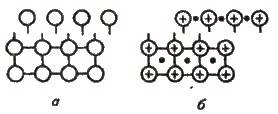
Рис. 12.1. Зміщення шарів у кристалах з решітками:
А – атомною; б – металічною
Різноманітні температури плавлення і кипіння металів. Найбільш легкоплавкий метал – ртуть, її температура плавлення
– 38,9°С, цезій і галій плавляться відповідно при 29,0 і 29,8°С. Вольфрам – найбільш тугоплавкий метал, температура його плавлення З 390°С. Він застосовується для виготовлення ниток електроламп. Метали, які плавляться при температурі понад 1 000°С, називають тугоплавкими, при нижчій – легкоплавкими. Значну відмінність в температурах плавлення і кипіння слід пояснювати відмінністю в міцності хімічного зв’язку між атомами в металах. Дослідження показали, що в чистому вигляді металічний зв’язок характерний лише для лужних та лужноземельних металів. Однак у інших металів, і особливо перехідних, частина валентних електронів локалізована, тобто здійснює ковалентні зв’язки між сусідніми атомами. А оскільки ковалентний зв’язок міцніший, ніж металічний, то у перехідних металів температури плавлення і кипіння, як це видно з рис. 12.2, набагато вищі, ніж у лужних та лужноземельних.
Метали відрізняються за твердістю. Найтвердіший метал – хром (ріже скло), найм’якіші – калій, рубідій та цезій. Вони легко ріжуться ножем.
Метали мають кристалічну будову. Більшість з них кристалізуються в кубічній решітці (див. рис. 3.18).