Фосфор
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ
§ 39. Фосфор
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати алотропні видозміни Фосфору, фізичні та хімічні властивості, поширеність у природі, добування і застосування фосфору;
Порівнювати алотропні видозміни Фосфору;
Складати рівняння та схеми електронного балансу відповідних хімічних рівнянь реакції.
Фосфор як хімічний елемент утворює понад 10 алотропних видозмін, найважливіші з них – білий, червоний і чорний фосфор. Алотропні
Фізичні властивості. Білий фосфор Р4 – біла речовина з жовтуватим відтінком (через домішки). Зовні він дуже схожий на очищений віск або парафін (мал. 59, а). Має молекулярну кристалічну гратку, у вузлах якої містяться молекули Р4 тетраедричної будови (мал. 59, б, в). Це м’яка і легкоплавка речовина (tпл = +44,1 °С), легко ріжеться ножем.
Він надзвичайно активний, поволі окиснюється киснем повітря, вже за кімнатної температури окиснення супроводжується блідо-зеленим світінням. Це явище називається хемілюмінесценцією. При
Білий фосфор надзвичайно отруйний (викликає ураження кісток, кісткового мозку, некроз щелеп). Летальна (смертельна) доза білого фосфору для дорослої людини становить 0,05 – 0,1 г. Розчинністю в карбон дисульфіді користуються для промислового очищення його від домішок.
Червоний фосфор Р – це більш стійка модифікація, ніж білий фосфор. Кристалічна гратка червоного фосфору – атомна (мал. 60, б, в), тому він дуже відрізняється від білого фосфору.
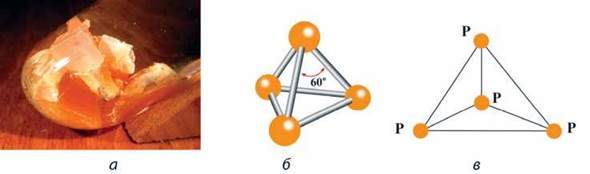
Мал. 59. Білий фосфор: а – зовнішній вигляд; б – модель; в – графічна форма молекули
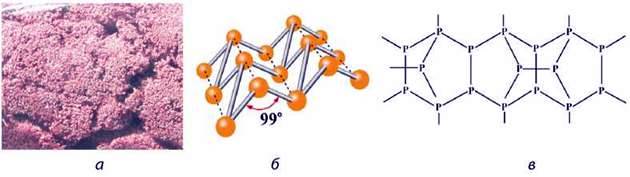
Мал. 60. Червоний фосфор: а – зовнішній вигляд; б – модель; в – фрагмент кристалічної гратки
Являє собою суміш щонайменше трьох видозмін, з яких переважає фіолетова (мал. 60, а). Без запаху, у воді та карбон дисульфіді нерозчинний, загоряється лише за +260 оС. Не плавиться, оскільки ще до плавлення переходить у пару білого фосфору. Не отруйний, не леткий. Це полімер зі складною структурою.
При зберіганні на повітрі червоний фосфор поступово поглинає воду, і тому його зберігають у герметично закритих посудинах. Хімічна активність червоного фосфору значно нижча, ніж білого, що пояснюється різною будовою їх кристалічних граток.
Чорний фосфор Р – найбільш стабільна і найменш активна форма Фосфору. Має атомну кристалічну гратку (мал. 61). Речовина з металічним блиском, жирна на дотик, тому схожа на графіт; нерозчинна у воді й органічних розчинниках, є напівпровідником. Не світиться, не леткий, не отруйний.
Під тиском 8,3 – 1010 Па чорний фосфор переходить у нову, більш щільну й інертну металічну видозміну, яка є провідником електричного струму.
“Жовтим” зазвичай називають неочищений білий фосфор. Це дуже отруйна і вогненебезпечна кристалічна речовина, із забарвленням від ясно-жовтого до темно-бурого кольору. Щоб уникнути самозаймання, жовтий фосфор зберігають і перевозять під шаром води.
– Складіть таблицю про порівняльні властивості алотропних видозмін Фосфору.
Хімічні властивості. Нагадаємо, що Фосфор у сполуках виявляє ступені окиснення +3 і +5 та -3. Тож у хімічних реакціях він може бути як відновником, так і окисником. Як відновник реагує з сильними окисниками – киснем і галогенами.
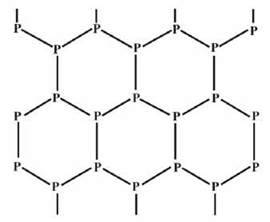
Мал. 61. Фрагмент кристалічної гратки чорного фосфору
Дослід. У ложечку для спалювання кладемо трохи (на кінчику ножа) червоного фосфору, запалюємо на повітрі і вносимо в колбу з киснем. Спостерігається яскраве горіння фосфору на повітрі та в кисні:
4Р + 5О2 = 2Р2 О5
Фосфор окиснюється складними речовинами-окисниками, наприклад розбавленою і концентрованою нітратною кислотою, бертолетовою сіллю:
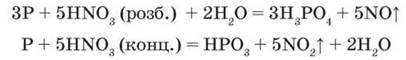
Хімічну реакцію взаємодії фосфору з бертолетовою сіллю КСlО3 можна спостерігати, якщо потерти сірником по боковій стінці коробки:
6Р +5КСlО3 = 3Р2О5 + 5KCl
– Доведіть відновні властивості фосфору, склавши схеми електронного балансу.
Ця реакція відбувається при запалюванні сірника. Бертолетова сіль у суміші з горючим компонентом (наприклад, сіркою) міститься в головці сірника, а червоний фосфор у суміші зі скляними крихтами – на боковій стінці коробки.
Як окисник фосфор взаємодіє з активними металами, при цьому він набуває ступеня окиснення -3. Продукти реакції називаються фосфідами, загальна формула Меx Рy. Наприклад, утворення магній фосфіду Мg3Р2:
3Мg + 2Р = Мg3Р2
Фосфіди – це сполуки, до складу яких входять атоми металічного елемента та Фосфору зі ступенем окиснення -3.
Отже, фосфор у хімічних реакціях може бути як відновником, так і окисником; більш характерними є відновні властивості.
Добування. У промисловості фосфор добувають при відновленні фосфориту вуглецем у суміші з піском за температури 1500 оС:
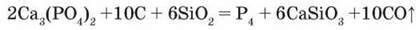
Пісок додають для того, щоб знизити температуру плавлення реакційної суміші. Це, в свою чергу, дає змогу збільшити вихід продукту. Пара білого фосфору, що утворюється, конденсується у приймачі під водою.
Пояснимо перебіг цієї реакції. Склад Са3(РО4)2 подамо у вигляді оксидів 3СаО – Р2О5. Під час нагрівання відбувається взаємодія основного оксиду СаО з кислотним оксидом SiO2:
СаО + SiO2 = CaSiO3, а Р2О5 відновлюється вуглецем:
2Р2О5 + 10С = P4 + 10С0 Застосування. Фосфор є найважливішим біогенним елементом і водночас широко застосовується у промисловості як проста речовина, засіб боротьби зі шкідниками рослин, для виготовлення сірників і лікарських препаратів, в органічному синтезі, добуванні фосфор(V) оксиду.
Коротко про головне
Елемент Фосфор утворює декілька алотропних видозмін (червоний, білий, чорний фосфор тощо). Вони мають різну будову, отже, різняться своїми фізичними і хімічними властивостями.
Найбільш стабільний – чорний фосфор. У хімічних реакціях найактивнішим є білий фосфор, виявляючи як відновні, так і окиснювальні властивості, переважно відновні. Промислове значення має червоний фосфор.