Гібридизація орбіталей – Ковалентний зв’язок – Типи хімічного зв’язку
ХІМІЧНИЙ ЗВ’ ЯЗОК
2. Типи хімічного зв’язку
2.3. Ковалентний зв’язок
Гібридизація орбіталей
Виходячи з конфігурації електронів, атом Карбону мав би бути двовалентним, утворюючи зв’язки в результаті перекривання двох напівзайнятих 2р-орбіталей з орбіталями інших атомів.
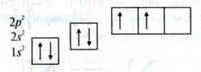
Проте це не так:
– Карбон у своїх сполуках найчастіше є чотиривалентним.
– У молекулі метану є чотири ідентичні зв’язки, які направлені до кутів правильного тетраедра.
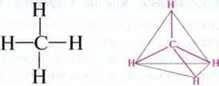
Чотиривалентність
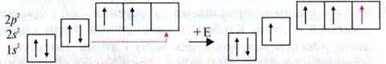
Такий стан не пояснює геометрію молекули, оскільки чотири зв’язки повинні бути ідентичними. Тобто орбіталі, що надані для зв’язку, мають “вирівнятися” за формою й енергією, і на цей процес потрібно затратити енергію. Уніфікацію різних орбіталей називають гібридизацією атомних орбіталей. Утворені гібридні орбіталі необхідно розглядати як гібриди первинних орбіталей.
Гібридизацію
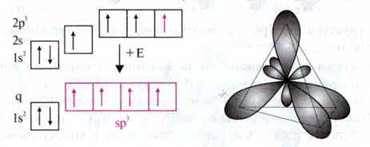
Приклад, у молекулі метану одна 2s – і три 2р-орбіталі атома Карбону гібридизовані в чотири ідентичні орбіталі. Вони утворюють з s-орбіталями атомів Гідрогену по одному σ-зв’язку.

Увага: іншими прикладами утворення sp3-гібридних орбіталей є атоми Карбону в кристалічній гратці алмазу, атоми Оксигену в молекулах води і атоми Нітрогену в молекулах амоніаку. При цьому атоми Карбону, Оксигену чи Нітрогену в sp3-гібридному стані також знаходяться в центрі тетраедра:
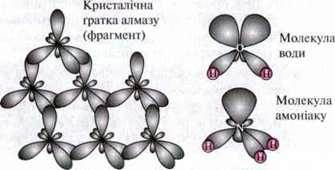
Структури цих трьох молекул можна пояснити за допомогою моделі:
– в алмазі від кожного атома Карбону виходять чотири однакових sp3-орбіталі, які утворюють чотири міцні ковалентні зв’язки з чотирма сусідніми атомами Карбону. Тривимірна “гігантська молекула”, яка виникла в результаті цього, має високу твердість і високу точку плавлення;
– у молекулі води лише дві з чотирьох sp3-гібридних орбіталей атома Оксигену вступають у зв’язок з атомами Гідрогену. Тому молекула має кутову форму;
– у молекулі амоніаку три з чотирьох sp3-гібридних орбіталей атома Нітрогену вступають у зв’язок з атомом Гідрогену. Тому молекула утворює трикутну піраміду.
Структуру сполук, молекули яких мають подвійні зв’язки між атомами Карбону, не можна пояснити sp3-гібридизацією орбіталей атома Карбону. У цих молекулах кожен атом Карбону утворює три однакові гібридні орбіталі, до того ж одна р-орбіталь атома Карбону вилучена з гібридизації, оскільки вона потрібна для утворення π-зв’язку. Отже, в гібридизації орбіталей беруть участь одна s – і дві р-орбіталі.
Гібридизацію однієї s – і двох p-орбіталей називають sp2-гібридизаціею. Утворені при цьому три орбіталі є sp2-гібридними орбіталями. Вони розташовані в одній площині з кутом між орбіталями 120°. Перпендикулярно до них розташована негібридна р-орбіталь.
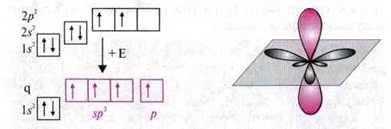
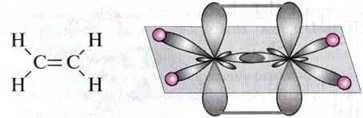
Приклад. У молекулі етену кожен атом Карбону утворює три σ-зв’язки і один π-зв’язок між атомами Карбону.
У кристалічній гратці графіту і в молекулі бензену атоми Карбону знаходяться в стані sp2-гібридизації. В обох випадках атоми Карбону утворюють плоскі шестичленні кільця.
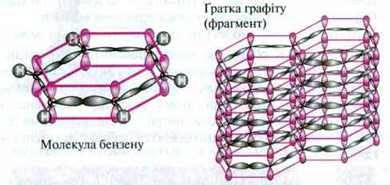
Негібридні р-орбіталі, розташовані вертикально до цієї площини, перекриваються між собою, утворюючи спільну π-орбіталь, в якій електрони не сполучені з якимось певним атомом Карбону.
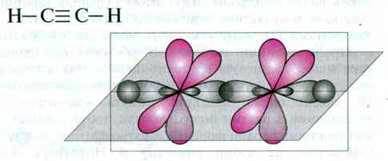
У молекулі етину між атомами Карбону існує потрійний зв’язок. При цьому з гібридизації орбіталей атома Карбону вилучаються дві p-орбіталі.
Гібридизацію однієї s – і однієї р-орбіталі називають sp-гібридизаціао. Утворені при цьому дві орбіталі є sp-гібридними орбіталями. Вони лежать на одній прямій лінії і утворюють кут між орбіталями 180°. Обидві негібридні р-орбіталі розташовані перпендикулярно до цієї прямої і утворюють між собою прямий кут.
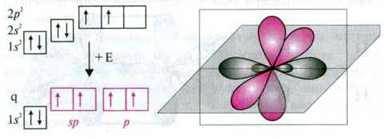
Приклад. У молекулі етину кожен атом Карбону утворює два σ-зв’язки і два π-зв’язки між атомами Карбону.