Маса і розміри молекул. Кількість речовини
ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ*
Урок № 4
Тема. Маса і розміри молекул. Кількість речовини
Мета: конкретизувати положення про масу молекул, відносну молекулярну масу, кількість речовин, молярну масу, число Авогадро.
Обладнання: періодична система елементів Менделєєва.
План уроку
1. Визначення маси молекул та її розмірів.
2. Для чого ввели відносну атомну масу речовин.
3. Поняття кількості речовин та її одиниця. Число Авогадро.
4. Молярна маса та її визначення.
5. Формула визначення числа молекул у речовині.
ХІД
I. Актуалізація опорних знань
1. Основні положення МКТ
2. Дослідне підтвердження основних положень МКТ
А) Що ви розумієте під дифузією? Навести приклад дифузії.
Б) Навести приклади явища дифузії в газах, рідинах, твердих тілах.
3. Поясніть, у чому полягає явище склеювання, зварювання і пресування металів.
II. Вивчення нового матеріалу
1. Із попереднього уроку ми знаємо, що всі речовини складаються із молекул. Тоді виникає питання, яка їх маса, розміри.
Уперше приблизні розміри молекул були визначені німецьким фізиком В. Рентгеном та англійським фізиком Д. Релеєм.
На сьогодні
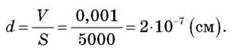
Діаметр молекул і дійсності ще менший і приблизно дорівнює діаметру кулі близько 10-8-10-9 см.
Як було сказано вище, молекула, наприклад, води, являє собою кулю d = 3-10-8 см, тож знайти кількість молекул Н2О можна навіть у краплі об’ємом 1 см3. Якщо поділимо об’єм краплі 1 см3 на об’єм однієї молекули (3-10-8 см) , кількість молекул у краплі води об’ємом 1см3 дорівнює:
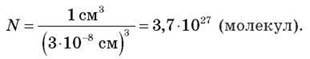
Обчислимо масу молекули Н2О. Ми вже знаємо що в 1 г води міститься приблизно 3,7-1027 молекул. Позначимо масу молекул Н2О через m0 H2O:
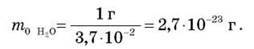
Маси атомів і молекул інших речовин відрізняються від маси молекули Н2O і одна від одної в десятки, а іноді в сотні разів.
Тільки-но було обчислено діаметр, масу і кількість молекул.
2. Обчислення показують, що маса молекул речовини надто мала і користуватися такими числами, запам’ятовувати їх і виконувати над ними математичні операції складно. Тому для зручності маси молекул і атомів вимірюють у відносних одиницях, порівнюючи із 1/12 маси Карбону:
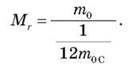
Відносна молекулярна маса безрозмірна величина.
Приклад. МrHе = 4,0026, подивимося в ПС і бачимо що для МгН = 4. Отже, за ПС ми можемо обчислити Mr – будь-якого хімічного елемента.
Крім відносної молекулярної маси користуються атомною одиницею маси (1 а. о. м). Експериментально встановлено, що атомна одиниця маси (а. о. м.) дорівнює 1,66-10-27 кг. Це дає можливість визначити, наприклад, масу молекули будь-якої речовини, знаючи відносну молекулярну масу цієї речовини і 1 а. о. м.
Наприклад,
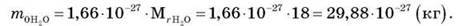
3. Якщо відома маса молекул якоїсь речовини, то легко дізнатися скільки молекул N міститься в будь-якому тілі, яке складається з цієї речовини масою m:
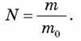
Число молекул речовин у будь-якому тілі називається кількістю речовини і позначається літерою v. Ця фізична величина є однією з основних величин, на яких грунтується Міжнародна система одиниць (СІ).
Якщо це фізична величина, то для неї треба обрати одиницю вимірювання.
За одиницю кількості речовини приймають таку кількість речовин, у якій міститься 6,2-1023 атомів, молекул (частинок).
Назвали цю одиницю моль (скороченого позначення ця одиниця не має).
Число молекул 1 моль є величина стала і дістало назву стала Авогадро (назвали на честь італійського вченого Авогардро). Стала Авогадро позначається NA;
NA = 6,02-1023 моль-1.
4. Масу 1 моля речовини називається молярною масою і позначають М. Молярна маса вимірюється в кг/моль.
Молярна маса пов’язана з відносною молекулярною масою.
Якщо відома маса речовини m і молярна маса М, то число молів у даному фізичному тілі визначиться формулою: v = m/M. 3 іншого боку число молів v визначимо через кількість молекул N і число атомів в 1 моль – NA:
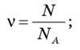
Ліві частини останніх рівнянь є рівними, отже, і праві можна прирівняти:
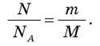
5. Число молекул у фізичному тілі визначається за формулою:
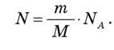
III. Закріплення вивченого матеріалу
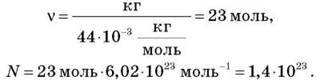
Задача. Визначити кількість речовини і кількість молекул, що містяться в 1 кг вуглекислого газу.
Дано: m = 1 кг, М = 44-10-3 кг/моль, N = 6,02-1023 моль-1.
Знайти: N = ? v = ?
Розв’язання
Знайдемо молекулярну масу СO2 за ПС:
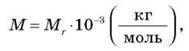
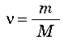 – кількість речовин,
– кількість речовин, 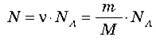 – кількість молекул,
– кількість молекул,
IV. Домашнє завдання
Опрацювати конспект.
Розв’язати задачі.
1. Густина алмазу 3500 кг/м3. Який об’єм займуть 1022 атомів цієї речовини.
2. Скільки молекул у 10 г кисню?