Нітроген – Елементи VA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.4. Елементи VA групи
9.4.2. Нітроген
Нітроген – 7-й елемент періодичної таблиці, заряд ядра – +7. Хімічний символ – N. Відносна атомна маса – 14, молярна маса – 28 г/моль. Відомо два стабільні природні ізотопи Нітрогену: 14N (99,64%), 15N. Утворює просту речовину азот N2.
Електронегативність за Полінгом – 3,04. Найхарактерніша валентність – III. Атом Нітрогену може приєднувати
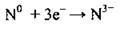
Утворюється нітрид-іон, який входить до складу бінарних сполук Нітрогену з типовими металічними елементами: K3N, Ca3N2.
Однак відомі сполуки Нітрогену, у яких він має валентність IV: HNО3, йон амонію NH4+, N2О5. Найнижчий ступінь окиснення – -3, а найвищий (у сполуках з електронегативнішими елементами Флуором і Оксигеном) – +5. Відомі також сполуки з проміжними ступенями окиснення Нітрогену:
Ступені окиснення | -3 | -2 | -1 | 0 | +1 | +2 | +3 | +4 | +5 |
Приклади | NH3, K3N | N2H4 | NH2OH | N2 | N2O | NO | N2O3, HNO2 | NO2 | N2O5, HNO3 |
Поширеність Нітрогену в природі
У природі Нітроген існує у вільному стані у вигляді простої речовини азоту N2. Об’ємна частка азоту в атмосферному повітрі становить 78,1 %. Зв’язаний Нітроген трапляється у вигляді солей нітратної кислоти, які традиційно називають селітрами: чилійською – NaNO3, натрієвою – NaNO3, калійною – KNO3.
Нітроген входить до складу органічних сполук, біологічно активних речовин: вітамінів, гормонів, антибіотиків, міститься в рослинних і тваринних організмах (білки, амінокислоти). Масова частка Нітрогену в організмі людини становить 3 %.
Фізичні властивості азоту
Азот – безбарвний газ без запаху і кольору, погано розчиняється у воді, дещо легший за повітря. При охолодженні до температури -196 °С перетворюється на безбарвну рідину, а при -210 °С твердне. Молекула азоту N2 складається з двох атомів Нітрогену, сполучених міцним потрійним неполярним ковалентним зв’язком. Ступінь окиснення Нітрогену в азоті – 0, а валентність – III. Кристалічні гратки твердого азоту молекулярні. Електронна формула – 7N 1s-22s22p3:
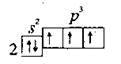
Добування азоту
У лабораторії азот добувають нагріванням кристалічного натрій нітриту з амоній хлоридом:

Амоній нітрит термічно нестійкий і відразу ж розкладається:
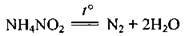
У промисловості азот добувають з повітря, його фракціонуванням (див. Добування кисню). Повітря дуже охолоджують до перетворення його на рідину, а потім поступово починають підвищувати температуру. Першим з рідкого повітря випаровується азот, оскільки температура його кипіння становить -196 °С.
Хімічні властивості азоту
Азот N2 має надзвичайно низьку реакційну здатність. Це пояснюється особливою стійкістю його молекули, яка починає розпадатися на атоми за температури 4 000 °С. Структурна формула азоту – N ≡ N, атоми сполучаються трьома ковалентними зв’язками:

Азот не горить і не підтримує горіння. Не реагує з водою, кислотами, лугами, солями. При нагріванні азот взаємодіє з деякими простими речовинами, виявляючи переважно властивості окисника:
1. 3 металами:
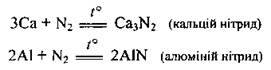
За стандартних умов взаємодіє лише з літієм:
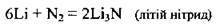
Нітриди лужних і лужноземельних металічних елементів – це йонні сполуки, які розкладаються водними розчинами кислот і водою (гідролізують):
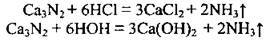
2. Азот взаємодіє з воднем за особливих умов (каталізатор – Fe, температура – 500 °С, тиск – ≥ 200 атм):
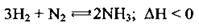
3. Азот виявляє відновні властивості у реакції з киснем, що відбувається за дуже високої температури (електрична дуга, 2000-3000 °С):
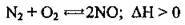
Застосування азоту і біологічне значення Нітрогену
В основному азот використовують для добування аміаку.
Інше застосування зумовлене його інертними властивостями:
– в енергетиці ним продувають охолоджувальні частини турбогенераторів ТЕЦ, ДРЕС, АЕС та електролізери від водню і повітря, а у нафтохімії – резервуари і трубопроводи (для проведення ремонтно-відновлювальних робіт), використовують для забезпечення вибухо – та пожежобезпеки при видобутку, перевезенні, зберіганні, переробці нафтопродуктів і хімічних речовин;
– у вугільній промисловості, при дегазації виробіток і гасінні пожеж, а також для забезпечення пожежної безпеки житлових, промислових споруд, офісів;
– освоєння свердловин у нафтогазовидобувній промисловості;
– у сучасних хіміко-технологічних процесах, де необхідне застосування інертного середовища;
– азотом наповнюють електричні лампочки;
– для тривалого і безвідходного зберігання сільськогосподарської продукції, зокрема фруктів, зерна і насіння в регульованому газовому середовищі;
– у харчовій промисловості, при виробництві олії, жирів, пакуванні продуктів.
Рідкий азот використовують як холодоагент для швидкого заморожування продуктів, для зберігання крові в медицині.
Нітроген – один з основних хімічних елементів живої природи, але ні рослини, ні тварини не можуть засвоювати атмосферного азоту. Цю функцію у природі виконують деякі прокаріоти (бактерії, археї).
Фіксація азоту (азотфіксація, або діазотрофія) – процес зв’язування азоту в хімічні сполуки (аміак, нітрати, нітроген(ІV) діоксид), які можуть використовуються рослинами для інших біохімічних процесів. Мікроорганізми, що фіксують азот, називають діазотрофами (азотфіксувальними мікроорганізмами). Деякі рослини, гриби і тварини формують з ними симбіотичні асоціації.
Найактивнішими фіксаторами атмосферного азоту є бульбочкові бактерії в асоціації з бобовими рослинами. За рік вони можуть нагромадити на площі 1 га до 60-300 кг азоту. Також до 30-60 кг/га азоту на рік зв’язує вільноживуча аеробна грунтова бактерія Azotobacter і до 20-40 кг/га – анаеробна маслянокисла бактерія Clostridium. Джерелом енергії і вуглецевого живлення для азотфіксаторів є кореневі виділення рослин, продукти розкладу клітковини та інших органічних решток. Для підвищення азотфіксувальної здатності до грунту вносять бактеріальні добрива.