Обчислення за хімічними формулами молярної маси й кількості речовини
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 6
Тема. Обчислення за хімічними формулами молярної маси й кількості речовини
Цілі уроку: поглибити уявлення учнів про молярну масу речовини; навчити використовувати набуті знання для обчислення за хімічними формулами молярної маси, маси й кількості речовини.
Тип уроку: формування вмінь і навичок.
Форми роботи: керована практика, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, картки із завданнями.
ХІД УРОКУ
I.
II. Перевірка домашнього завдання
Хімічний диктант
1) Скільки атомів Феруму міститься в 1 моль заліза? (6,02 – 1023 атомів)
2) Молярна маса молекули кисню О2 дорівнює… (32 г/моль)
3) Формула розрахунку кількості речовини за відомою масою речовини. ( = m/Мm)
= m/Мm)
4) Стала Авогадро NA дорівнює… (б,02 – 1023 частинок/моль)
5) Одиниці вимірювання молярної маси. (кг/моль або г/моль)
У цей час два учні на дошці наводять розв’язання домашніх задач.
III. Формування навичок і вмінь
Учитель. Сьогодні ви навчитеся здійснювати обчислення за хімічними формулами
На аркуші наведені задачі, які ми розв’яжемо з використанням вивчених на попередньому уроці формул, а також формули, що знадобиться для розрахунків у процесі розв’язання задач.
Записуємо на дошці формули:
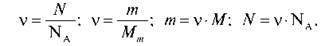
Розв’язання задач. Практика на прикладах
Задача 1
Розрахуйте кількість речовини натрій хлориду (NaCl) масою 117 г.
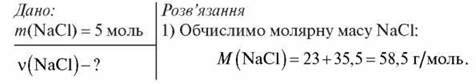
2) За формулою  = m/Мm:
= m/Мm:
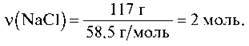
Відповідь: 2 моль.
Задачі для самостійного розв’язання
Задача 2
Обчисліть масу 5 моль сульфатної кислоти H2SО4.

2) 3 формули  = m/М випливає:
= m/М випливає:
M =  – М,
– М,
Тоді
M(H2SO4) = 5 моль – 98 г/моль = 490 г.
Відповідь: 490 г.
Задача 3
Обчисліть масу кальцій карбонату (СаСО3) кількістю речовини 3 моль.

2) 3 формули  = m/М випливає:
= m/М випливає:
M =  – М,
– М,
Тоді
M(СаСO3) = 3 моль – 100 г/моль = 300 г.
Відповідь: 300 г.
Керована практика
Задача 4
Обчисліть кількість атомів Феруму у ферум(ІІ) сульфіді масою 352 г.
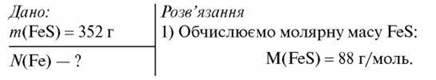
2) За формулою  = m/Мm обчислюємо кількість речовини FeS:
= m/Мm обчислюємо кількість речовини FeS:
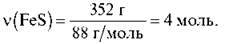
3) 3 формули  = N/NA випливає: N =
= N/NA випливає: N =  – NA.
– NA.
Обчислюємо число молекул FeS:
N(FeS) = 4 моль – 6,02 – 1023 молекул/моль = 24,08 – 1023 молекул.
4) Оскільки молекула FeS складається з одного атома Феруму й одного атома Сульфуру, то
N(Fe) = N(S) = 24,08 – 1023 (атомів).
Відповідь: 24,08 – 1023 атомів.
Задача 5
Обчисліть кількість атомів Оксигену в молекулярному кисні масою 64 г.
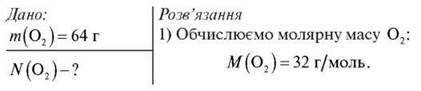
2) За формулою  = m/Мm обчислюємо кількість речовини O2:
= m/Мm обчислюємо кількість речовини O2:
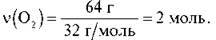
3) 3 формули  = N/NA випливає: N =
= N/NA випливає: N =  – NA.
– NA.
Обчислюємо число молекул O2:
N(O2) = 2 моль – 6,02 – 1023 молекул/моль = 12,04 – 1023 молекул.
4) Оскільки молекула O2 складається з двох атомів Оксигену, то
N(O2) = 2 – N(O) = 2 – 12,04 – 1023 = 24,08 – 1023 (атомів).
Відповідь: 24,08 – 1023 атомів.
Задача 6
Обчисліть, в якій масі води міститься така ж кількість молекул води, скільки атомів містить кальцій масою 80 г.
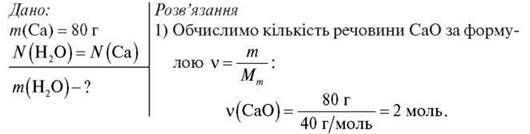
2) Нам відомо, що N(H2O) = N(Ca). А з формули  = N/NA випливає, що
= N/NA випливає, що  (H2O) =
(H2O) =  (Ca) = 2 моль.
(Ca) = 2 моль.
3) За формулою m =  – M обчислюємо масу 2 моль Н2O:
– M обчислюємо масу 2 моль Н2O:
M(Н2O) = 18 г/моль;
M(Н2O) = 2 моль – 18 г/моль = 36 г.
Відповідь: 36 г.
Задача 7
Обчисліть, у якій масі кисню міститься така ж кількість молекул, що й у 10 г водню Н2.
IV. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання.
Творче завдання (домашня практика). Самостійно розв’язати задачі 2, 4, 6, 8 з картки на окремому аркуші.