Одержання амоніаку в лабораторії. Загальна схема одержання амоніаку в промисловості
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 10
Тема уроку. Одержання амоніаку в лабораторії. Загальна схема одержання амоніаку в промисловості
Цілі уроку: ознайомити учнів із загальними закономірностями виробництва амоніаку; з’ясувати умови синтезу амоніаку, за яких можна керувати хімічною рівновагою; розвивати вміння й навички розв’язувати задачі з використанням поняття “вихід продукту реакції”; показати значення таких розрахункових задач у промисловій і лабораторній практиці.
Тип уроку:
Форми роботи: навчальна лекція, розв’язання розрахункових задач, робота з опорною схемою, демонстраційний експеримент.
Обладнання: періодична таблиця хімічних елементів, схема виробництва амоніаку (медіафрагмент).
Демонстрація 4. Одержання амоніаку й розчинення його у воді.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Фронтальне опитування
1. Як реагують індикатори на водний розчин амоніаку? Обгрунтуйте свою відповідь.
2. Доведіть, які властивості
3. Запропонуйте хімічні реакції для одержання амоній хлориду, маючи водень, хлор і азот. Напишіть рівняння реакцій.
4. У пронумерованих пробірках видано розчини сульфатної кислоти, натрій сульфату й амоній сульфату. Запропонуйте, як дослідним шляхом можна розпізнати їх. Складіть план відповіді, напишіть відповідні рівняння реакцій.
5. Розкажіть, на якій властивості амоніаку грунтується якісна реакція на іон амонію.
6. Згадайте, за яких умов протікає хімічна реакція одержання амоніаку, запишіть рівняння реакції.
ІІІ. Вивчення нового матеріалу
Одержання амоніаку
Демонстрація 4. Одержання амоніаку й розчинення його у воді
1. У лабораторії амоніак одержують за схемою:
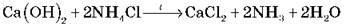
Як зібрати амоніак? (Газ легший за повітря, отже, його можна зібрати, витісняючи повітря з перевернутої пробірки)
Пробірку з амоніаком занурюємо у воду дном догори.
Чому піднімається стовп води? (Амоніак розчиняється у воді)
Якого забарвлення набуває у водному розчині амоніаку фенолфталеїн? лакмус? Чому?
Запишіть рівняння дисоціації амоній гідроксиду:
NH4OH 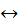 NH4+ + OH-
NH4+ + OH-
2. У промисловості амоніак одержують за схемою:
N2 + 3H2 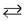 2NH3 + 92,4 кДж (t° = 450 °C, Р = 800 атм, kat)
2NH3 + 92,4 кДж (t° = 450 °C, Р = 800 атм, kat)
Демонстрація. Одержання NH3 і розчинення його у воді з фенолфталеїном
Промисловий синтез амоніаку (розповідь учителя)
Процес синтезу амоніаку ускладнюється тим, що за високих температур і тиску водень дифундує крізь звичайні сталі, а азот і амоніак реагують з ними. Каталізатор отруюється сполуками Сульфуру, що містяться у вихідних газах, киснем, водяною парою та ін.
Оптимальні умови проведення синтезу амоніаку: t° > 400 °С, kat – Fe, Р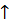 .
.
З міркувань економії як каталізатор обирають залізо, в яке для посилення активності й подовження терміну служби додають Al2O3 і K2O.
Зі збільшенням тиску ускладнюється конструкція апаратів, але все одно 100%-го виходу амоніаку одержати не вдається через оборотність реакції. Проблему розв’язали іншим шляхом: з газової суміші в колоні синтезу з умістом амоніаку 10-20 % його відокремлюють, охолоджуючи суміш до кімнатної температури, за якої амоніак під тиском перетворюється на рідину. Азот і водень спрямовують назад у колону синтезу, тобто використовують рециркуляцію азотно-водневої суміші. Завдяки цьому вдається обмежитися порівняно невеликим тиском – 30 МПа = 300 атм (на новітніх установках – до 150 атм).
Реагенти: N2 – з повітря, H2 – з природних горючих газів (СН4).
Колона синтезу (розглядаємо схему виробництва амоніаку) Подвійний циліндр, між стінками якого рухається суміш N2 і H2. Суміш розігрівається в трубковому теплообміннику за рахунок гарячої суміші, що залишає каталізаторну коробку (тобто теплоти хімічної реакції). Теплоти стільки, що туди часто вміщують і труби парового опалення для утилізації тепла, що виділяється.
IV. Розв’язання задач на обчислення масової частки виходу продукту реакції від теоретично можливого
Маса речовини, розрахована на підставі даних рівняння реакції, називається теоретичним виходом продукту mтеор.
Маса речовини, реально одержана в результаті реакції, називається практичним виходом продукту mпракт.
Частина речовини в процесі реакції губиться, вихідні речовини містять домішки, унаслідок хімічної рівноваги взаємодіють не повністю, тому завжди mпракт < mтеор.
Отже, масова частка виходу продукту реакції від теоретично можливого:
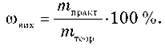
Для обчислень використовується також поняття “мольна частка” виходу продукту реакції:
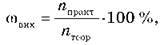
Або для газоподібних продуктів реакції об’ємна частка виходу продукту реакції:
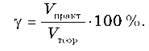
Розглянемо застосування цих формул на прикладах.
Задача 1. У результаті взаємодії 55,5 г кальцій гідроксиду з амоній хлоридом одержали 15 г NH3. Обчисліть мольну частку виходу амоніаку від теоретично можливого.
– Складаємо рівняння реакції:
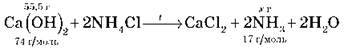
– Обчислюємо кількість речовини кальцій гідроксиду за даними задачі:
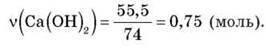
– Обчислюємо теоретичну кількість речовини амоніаку за рівнянням реакції:
?теор = 0,75 – 2 = 1,5 (моль).
– Обчислюємо практичну кількість речовини за даними задачі:
Vпракт (NH3) = 15/17 = 0,88 (моль).
– За формулою обчислюємо мольну частку виходу амоніаку від теоретично можливого:
?вих (NH3) = 0,88/1,5 – 100% = 59%.
Відповідь: 59 %.
Задача 2. У процесі нагрівання суміші 33 г амоній сульфату з надлишком кальцій гідроксиду одержали амоніак об’ємом 9,5 л (н. у.). Обчисліть об’ємну частку виходу амоніаку від теоретично можливого.
Задача 3. Обчисліть об’єм амоніаку (н. у.), який можна одержати, нагріваючи 75 г амоній сульфату з надлишком кальцій гідроксиду, якщо об’ємна частка виходу амоніаку становить 96 %.
V. Підбиття підсумків уроку
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.