Окисно-відновні реакції
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 10. Окисно-відновні реакції
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати значення окисно-відновних реакцій, суть процесів окиснення й відновлення, понять окисник і відновник; визначати окисник і відновник; складати схеми електронного балансу;
Розставляти коефіцієнти у рівняннях окисно-відновних реакцій.
Пригадаємо означення:
Реакції, під час яких змінюються ступені окиснення елементів, що входять до складу реагуючих речовин,
Будь-яка окисно-відновна реакція (ОВР) складається з процесів окиснення і відновлення. Окиснення – це процес віддавання електронів, тобто підвищення ступеня окиснення елемента. Речовини, які у процесі реакції віддають електрони, називаються відновниками.
Наприклад, Zn0 – 2е-› Zn+2.
Процес окиснення: Цинк – відновник.
До типових відновників належать прості речовини, атоми яких мають низьку електронегативність, наприклад метали, вуглець, водень.
Відновлення – це процес приєднання електронів, тобто зниження ступеня окиснення елемента. Речовини, які під
Наприклад, Cu2+ + 2е -› Cu0.
Процес відновлення: Йон Си2+ – окисник.
До типових окисників належать прості речовини, атоми яких мають високу електронегативність, наприклад галогени, кисень, а також катіони й аніони, що містять атоми з високим ступенем окиснення:
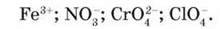
Слід пам’ятати, що один і той самий елемент може виявляти різні властивості: окисні (у високих ступенях окиснення) і відновні (у нижчих ступенях окиснення). Так, Сульфур у 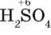 виявляє окиснювальні властивості, а Сульфур у
виявляє окиснювальні властивості, а Сульфур у 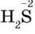 – відновні властивості.
– відновні властивості.
Один і той самий елемент в одному і тому самому ступені окиснення залежно від умов реакції може виявляти як окиснювальні, так і відновні властивості. Так, водень у реакціях з металами – окисник, а в реакціях із неметалами або оксидами металічних елементів – відновник:
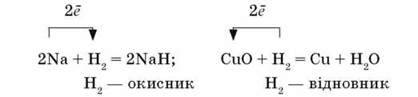
Окисно-відновні реакції мають дуже складний характер. Відокремлений перебіг реакцій окиснення і відновлення відбувається лише в електрохімічних процесах. У хімічних ОВР окиснення і відновлення взаємопов’язані.
Відомо кілька методів складання рівнянь ОВР. Нагадаємо алгоритм дій, які необхідно виконати для складання рівнянь цих реакцій:
– записати схему реакції – формули вихідних речовин і продуктів реакції;
– визначити елементи, атоми яких змінюють ступінь окиснення;
– скласти електронні рівняння напівреакцій окиснення і відновлення;
– знайти додаткові множники-коефіцієнти;
– поставити коефіцієнти у схемі реакції, вона перетвориться на рівняння реакції (перевірка!).
Наприклад, потрібно скласти рівняння реакції окиснення ферум(ІІ) сульфату калій перманганатом у кислому середовищі. Оскільки реакція відбувається в кислому середовищі, то в лівій частині рівняння, крім окисника і відновника, має бути кислота, зазвичай розбавлена сульфатна. Продуктами реакції мають бути сульфати Мангану(ІІ), Калію, Феруму(ІІІ) і вода. Схема реакції і наступні дії:
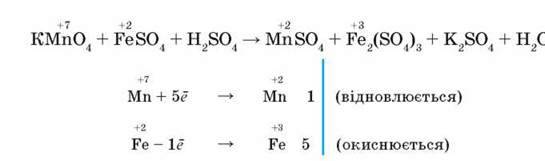
Отже, для збереження балансу відданих і приєднаних електронів у лівій та правій частинах рівняння має бути по 10 атомів Феруму і по два атоми Мангану:
2KMnO4 + 10FeSO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H, O
Окисно-відновні реакції дуже різноманітні. Їх значення в хімії, технології та повсякденному житті людини важко переоцінити. ОВР лежать в основі добування металів і сплавів, водню і галогенів, лугів та лікарських препаратів. З ними тісно пов’язано функціонування біологічних мембран, процеси дихання і травлення, робота хімічних джерел струму (акумуляторів і батарейок) тощо.
Коротко про головне
Характерною ознакою окисно-відновних реакцій (ОВР) є зміна ступенів окиснення елементів, що входять до складу реагуючих речовин.
Процес віддавання електронів – це окиснення, а процес їх приєднання – це відновлення.
Елементи, а отже, й речовини, що віддають електрони, є відновниками, а які їх приєднують – окисниками.
Відновники, віддаючи електрони, окиснюються, а окисники, приєднуючи їх, відновлюються. Отже, окиснення завжди супроводжується відновленням і навпаки. Це означає, що окисно-відновні реакції – єдність двох протилежних процесів – окиснення і відновлення.
Окисно-відновні властивості атомів елементів залежать від їх електронегативності: чим більша електронегативність елемента, тим сильніші його окиснювальні властивості, і навпаки, чим менша електронегативність, тим сильніші відновні властивості елемента.