Оксиди Нітрогену
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ
§ 35. Оксиди Нітрогену
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати будову молекул оксидів Нітрогену(ІІ) і (IV), їх фізичні та хімічні властивості, добування і застосування; висловлювати судження про вплив оксидів Нітрогену на довкілля; складати рівняння та схеми електронного балансу відповідних хімічних реакцій.
Нітроген утворює п’ять оксидів зі ступенями окиснення від +1 до +5. Серед них найбільше практичне значення мають нітроген(ІІ)
– Складіть формули можливих оксидів Нітрогену.
Нітроген(ІІ) оксид NO. Хімічна формула – NО, електронна – :N::0: (радикал), Мг (NО) = 30, М (NО) = 30 г/моль. Молекула лінійна, речовина молекулярної будови (мал. 53).
– 1. Зобразіть схематично, як утворюються дві ковалентні пари електронів між атомами Нітрогену й Оксигену в молекулі NО.
– 2. Чи можуть дві молекули NO сполучатися між собою ковалентним зв’язком і утворити димер N2O2?
Зверніть увагу, що в молекулі NO в атома Нітрогену залишається вільний електрон, завдяки якому виникає додатковий зв’язок (мал. 53, б). При цьому за зниженої
Фізичні властивості. За стандартних умов нітроген(ІІ) оксид – безбарвний газ без запаху, з низькими температурами плавлення і кипіння, трохи важчий за повітря, погано розчиняється у воді.
– Запропонуйте способи збирання нітроген(ІІ) оксиду в посудину.
Хімічні властивості. Нітроген(ІІ) оксид належить до несолетворних оксидів, тому не взаємодіє ні з кислотами, ні з лугами. Він має високу відновну властивість, яка пояснюється низьким ступенем окиснення Нітрогену +2.
Уявімо, що з циліндра, в якому міститься безбарвний нітроген(ІІ) оксид, зняли скляну пластину. Над циліндром з’являється бура хмара нітроген(ІV) оксиду з різким запахом. Реакція екзотермічна й оборотна:
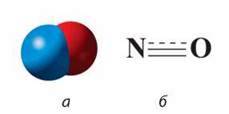
Мал. 53. Молекула NO: а – модель; б – структурна формула
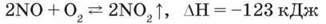
Нітроген(ІІ) оксид може бути й окисником, наприклад, при взаємодії з воднем за певної температури:
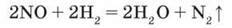
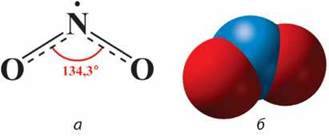
Мал. 54. Молекула NO2: а – просторова будова; б – модель
– Підтвердіть відновні та окиснювальні властивості нітроген(ІІ) оксиду, склавши схеми електронного балансу.
Нітроген(ІV) оксид NO2. Хімічна формула – NО2. Мг(NО2) = 46, М(NО2) = 46 г/моль. Хімічний зв’язок між атомами в молекулі NO2 ковалентний полярний, просторова будова молекули NО2 кутова (мал. 54), кристалічна гратка молекулярна.
Фізичні властивості. За стандартних умов нітроген(ІV) оксид – це газ бурого кольору, з характерним гострим запахом, дуже отруйний, з низькими температурами кипіння і плавлення. (Чому?) Важчий за повітря, добре розчиняється у воді, бо молекула N02, як і молекула води, має кутову форму.
– Запропонуйте способи збирання нітроген(ІV) оксиду в посудину. Завдяки неспареному електрону в атомі Нітрогену молекули NO2 схильні до димеризації, як і молекули NO. Димер N2O4 – безбарвна кристалічна речовина (за t = 89,3 оС), стійка за низької температури, а під час нагрівання розкладається:
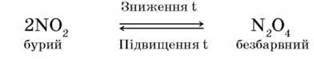
Фізіологічна дія. Пари оксидів нітрогену токсичні за винятком нітроген(І) оксиду N2O. Вони уражають легені, в еритро-, лімфо – та моноцитах відбуваються зміни конфігурації, що призводить до зниження кров’яного тиску, збільшення розмірів печінки і селезінки, розладу психіки.
Хімічні властивості. Нітроген(ІV) оксид – це солетворний кислотний оксид. Він не лише добре розчиняється у воді, а водночас реагує з нею, утворюючи дві кислоти: нітритну – HNO2 і нітратну – HNO3:
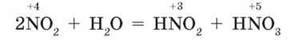
Нагадаємо, що це реакція самоокиснення – самовідновлення, або диспропорціювання.
Як кислотний оксид нітроген(ІV) оксид реагує з лугами, утворюючи солі нітритної та нітратної кислот, наприклад натрій нітрит NaNO2 і натрій нітрат NaNO3:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Якщо реакція нітроген(ІV) оксиду з водою або розчином лугу проходить за наявності кисню, то утворюються відповідно лише нітратна кислота і лише нітрат:
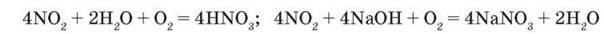
– Визначте типи хімічних реакцій і властивості нітроген(ІV) оксиду в них. Нітроген(ІУ) оксид – сильний окисник. Сірка, фосфор і вугілля, запалені на повітрі, продовжують горіти в атмосфері нітроген(ІV) оксиду. Наприклад, рівняння реакції горіння сірки:
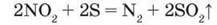
– Визначте властивості реагентів, склавши схеми електронного балансу.
Рідкий і твердий нітроген(ІV) оксид – безбарвні, утворюють з багатьма органічними речовинами вибухові суміші.
Застосування. На окиснювальних властивостях нітроген(ІV) оксиду засновано використання його як окисника у ракетному паливі. Ця речовина є проміжним продуктом у виробництві нітратної кислоти.
Захист довкілля від оксидів Нітрогену. Нітроген(ІІ) оксид належить до найнебезпечніших забруднювачів повітря. Він потрапляє в атмосферу з вихлопними газами наземного й авіаційного транспорту, ракетоносіїв, із викидами установок перегонки і крекінгу при переробці нафти. Одним із головних джерел забруднювачів довкілля є теплоенергетика. На її частку припадає майже 60 % NO. Оксиди Нітрогену утворюють кислотні дощі, завдаючи тим самим великої шкоди живим організмам.
Зменшують утворення оксидів Нітрогену в теплоенергетиці спалюванням подрібненого вугілля в потоці повітря. Цим досягається зниження температури згоряння палива або пального. Як запобіжні заходи на транспорті може бути введення різних добавок до пального або заміна його етиловим спиртом чи стисненим газом. Неабияке значення має правильне регулювання роботи двигунів автомобілів та дотримання оптимальних умов виробництва нітратної кислоти, переробки нафти тощо.
Коротко про головне
Найбільше практичне значення мають нітроген(ІІ) оксид і нітроген(ІV) оксид. Нітроген(ІІ) оксид – несолетворний, сильний відновник, а нітроген(ІV) оксид – солетворний, сильний окисник, обидва отруйні. Спричиняють негативний вплив на довкілля. У природі нітроген(ІІ) оксид може утворюватися під час грози або за дуже високої температури, а нітроген(ІV) оксид – окисненням нітроген(ІІ) оксиду киснем повітря.