Оксиген і його властивості – ПІДГРУПА ОКСИГЕНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 9. ПІДГРУПА ОКСИГЕНУ
§ 9.2. Оксиген і його властивості
Поширення в природі. Оксиген – найпоширеніший на Землі елемент. Він становить 47,2 % маси земної кори. Його вміст у повітрі становить 20,95 % за об’ємом або 23,15 % – за масою. Оксиген входить до складу води, гірських порід, багатьох мінералів і солей, міститься у білках, жирах і вуглеводах, з яких складаються живі організми.
Добування. У лабораторних умовах кисень добувають електролізом
2КСlO2 = 2КСl + 3O2 ↑.
Дуже чистий кисень утворюється при розкладі перманганату калію:
2КМnO4 = К2МnО4 + МnО2 + O2 ↑ .
У промисловості кисень добувають із рідкого повітря, а також при добуванні водню електролізом води. Кисень зберігають і перевозять у стальних балонах під тиском до 15 МПа (мегапаскаль).
Фізичні властивості. Кисень – газ без кольору, смаку і запаху, трохи важчий
Молекула кисню складається з двох атомів O2. Хімічний зв’язок у ній – ковалентний неполярний.
Молекула озону складається з трьох атомів оксигену О3. Озон – це алотропічна модифікація елемента оксигену. Хоча кисень і озон утворені одним і тим самим елементом, властивості їх різні. Озон – газ із характерним запахом. Руйнує органічні речовини, окиснює багато металів, у тому числі золото і платину; він сильніший окисник, ніж кисень. Наприклад, з розчину йодиду калію він виділяє йод, в той час як з киснем ця реакція не відбувається:
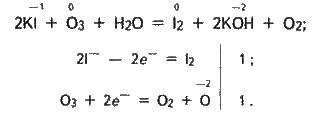
Озон чинить вибілюючу й дезінфікуючу дію.
Найважливіша хімічна властивість кисню – здатність утворювати оксиди майже з усіма елементами (для перших трьох благородних газів оксиди не добуто). При цьому з більшістю речовин кисень взаємодіє безпосередньо, особливо при нагріванні. Наприклад:
2Са + O2 = 2СаО. (а)
Кисень не взаємодіє безпосередньо з галогенами, золотом і платиною, їх оксиди добувають непрямим шляхом.
Складні речовини за певних умов також взаємодіють з киснем. При цьому утворюються оксиди, а в деяких випадках – оксиди і прості речовини. Наприклад:
2С2Н2 + 5O2= 4СO2 + 2Н2O; (6)
4NH3 + 3O2 = 6Н2О + 2N2. (в)
Оксиген як окисник. За величиною відносної електронегативності оксиген є другим елементом (х = 3,50, див. табл. 2.2). Тому в хімічних реакціях як з простими, так і зі складними речовинами він є окисником, оскільки приймає електрони. З іншого боку, кальцій, карбон зі ступенем окиснення -1 і нітроген зі сту пенем окиснення -3 віддають електрони, тому Са, С2Н2 і NH3 є відновниками.
Горіння, іржавіння, гниття і дихання відбуваються за участю кисню. Це окисно-відновні процеси.
Інтенсифікація хімічних і металургійних процесів. Процеси окиснення інтенсивніше відбуваються в кисні, ніж на повітрі. Це підтверджується простими дослідами: горінням вугілля, сірки, стального дроту в кисні.
Для прискорення процесів окиснення замість звичайного повітря застосовують кисень або повітря, збагачене киснем. Кисень використовується для інтенсифікації окисних процесів у хімічній промисловості (виробництво нітратної і сульфатної кислот, штучного рідкого палива, мастил та інших речовин).
Кисень – ефективний засіб інтенсифікації металургійних процесів. При продуванні в доменну піч повітря, збагаченого киснем, значно підвищується температура полум’я, внаслідок чого прискорюється процес плавки і зростає продуктивність печі. Ще більший ефект спостерігається при повній або частковій заміні повітря киснем у сталеплавильному виробництві – мартенівському і бесемерівському процесах: відбувається не тільки інтенсифікація цих процесів, а й покращується якість сталей, що добуваються. Успішно застосовується збагачене киснем повітря (до 60 % О2) у кольоровій металургії (окиснення сульфідних руд цинку, міді та інших металів).
Застосування. Металургійна промисловість використовує досить багато кисню. Кисень застосовується для досягнення високих температур. Температура киснево-ацетиленового полум’я досягає З 500°С, киснево-водневого – З 000°С.
У медицині кисень застосовується для полегшення дихання хворих (кисневі подушки і палатки). Він використовується в кисневих приладах під час виконання робіт у важкій для дихання атмосфері (підземні й підводні роботи, висотні й космічні польоти тощо).