Основні класи неорганічних сполук
ВСТУП
Урок 1
Тема уроку. Основні класи неорганічних сполук
Цілі уроку: повторити хімічні поняття, розглянуті під час вивчення хімії 8 класу; узагальнити й систематизувати знання про класи неорганічних сполук, їх генетичні зв’язки, хімічні властивості.
Тип уроку: узагальнення й систематизації знань.
Форми роботи: фронтальна бесіда, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, опорні схеми.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань
У
Фронтальна бесіда
– Назвіть основні поняття й закони, вивчені у 8 класі. Дайте визначення поняттям: моль, молярна маса, молярний об’єм та ін.
– Наведіть формулювання законів:
¦ збереження маси;
¦ об’ємних відносин;
¦ періодичного закону.
III. Узагальнення й систематизація знань
1. Розминка (фронтальна робота)
Учні відгадують хімічні загадки.
1) Кислота тепла боится, быстро в воду превратится. (Карбонатна, сульфатна кислоти)
2) Самой сильной из кислот имя галоген
3) Капля воды попала на кусок и превратилась в кипяток. (Розчинення лужного металу у воді)
4) Молоко не скисло, на стене повисло. (Вапняне молоко)
5) Природной соли маленький кусок отвечать помог урок. (Кальцій карбонат, крейда)
6) Порознь каждый ядовит, вместе будет – аппетит. (Натрій хлорид)
7) Расскажите, в чем тут дело: гасили то, что не горело? (Гасіння соди, вапна)
8) На полях они витамины, а на складе вроде мины. (Нітрати)
9) Красив, наряден карбонат, ему строитель очень рад. (Мармур, вапняк)
10) Поташ, селитру, сильвинит какой металл обгединит? (Калій)
11) Какой элемент называют по имени одной части света? (Європій) (Натрій хлорид, хлористий натрій, натрієва сіль хлороводневої кислоти, кам’яна сіль, натрій хлор, кухонна сіль)
2. Класи неорганічних сполук
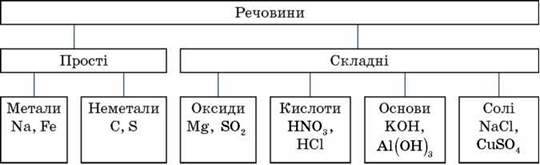
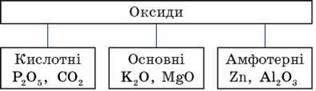
А. Оксиди – складні сполуки, що складаються з двох хімічних елементів, один з яких – Оксиген валентністю II.
Б. Основи – складні речовини, що складаються з атомів металів, з’єднаних з однією або кількома гідроксильними групами.
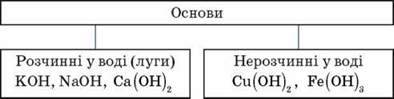
Увага! Луги утворюють лише десять елементів періодичної системи хімічних елементів Д. І. Менделєєва: шість лужних металів – літій, натрій, калій, рубідій, цезій, францій, та чотири лужноземельні метали – кальцій, стронцій, барій, радій.
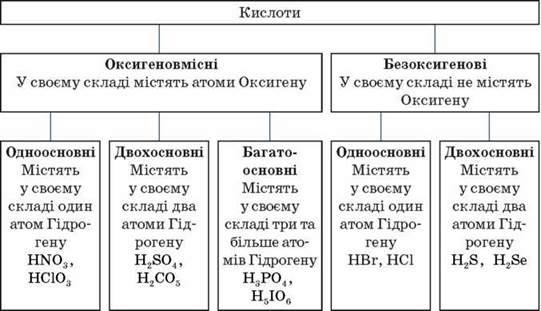
В. Кислоти – складні речовини, утворені одним або кількома атомами Гідрогену, з’єднаними з кислотним залишком.
Г. Солі – складні речовини, утворені атомами металів, з’єднаними з кислотними залишками.
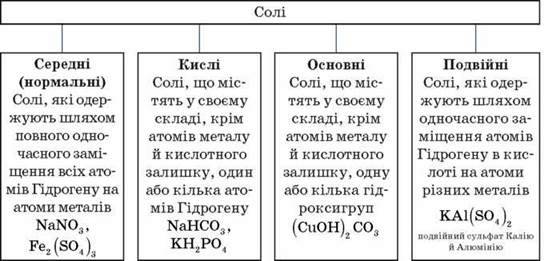
Увага! Щоб правильно назвати кислу сіль, необхідно до назви нормальної солі додати префікс гідроген – або дигідроген – залежно від числа атомів Гідрогену, що входять до складу кислої солі.
Формули й назви кислот і кислотних залишків
Кислота | Кислотний залишок | ||
Назва | Формула | Назва | Формула |
Хлоридна (соляна) | HCl | Хлорид | Cl- |
Флуоридна(плавикова) | HF | Флуорид | F- |
Бромідна(бромоводнева) | HBr | Бромід | Br- |
Іодидна (іодоводнева) | HI | Іодид | I- |
Хлорнуватиста | HClO | Гіпохлорит | ClO- |
Хлорнувата | HClO3 | Хлорат | ClO3- |
Хлорна | HClO4 | Перхлорат | ClO4- |
Нітритна (азотиста) | HNO2 | Нітрит | NO2- |
Нітратна (азотна) | HNO3 | Нітрат | NO3- |
Сульфідна (сірководнева) | H2S | Сульфід | S2- |
Гідрогенсульфід | HS- | ||
Сульфітна (сірчиста) | H2SO3 | Сульфіт | SO32- |
Гідрогенсульфіт | HSO3- | ||
Сульфатна (сірчана) | H2SO4 | Сульфат | SO42- |
Гідрогенсульфат | HSO4- | ||
Карбонатна (вугільна) | H2CO3 | Карбонат | CO32- |
Гідрогенкарбонат | HCO3- | ||
Силікатна | H2SiO3 | Силікат | SiO32- |
Фосфатна (ортофосфатна) | H3PO4 | Ортофосфат | PO43- |
Гідрогенортофосфат | HPO42- | ||
Дигідрогенортофосфат | H2PO4- | ||
Мурашина | НСООН | Форміат | HCOO- |
Оцтова | CH3COOH | Ацетат | CH3COO- |
Наприклад, KHCO3 – калій гідрогенкарбонат;
KH2PO4 – калій дигідрогенортофосфат.
Слід пам’ятати, що кислі солі можуть утворювати дві й більше основні кислоти, як оксигеновмісні, так і безоксигенові.
Щоб назвати основну сіль, необхідно до назви нормальної солі додати префікс гідрокси – або дигідрокси – залежно від числа груп OH-, що входять до складу солі.
Наприклад, (CuOH)2CO3 – купрум(ІІ) гідроксикарбонат.
Слід пам’ятати, що основні солі здатні утворювати лише основи, що містять у своєму складі дві й більше гідроксигруп.
Однак слід розуміти, що багато які з кислих і основних солей можуть існувати лише теоретично, реально ж у розчинах такі солі, як правило, нестабільні.
Основні способи одержання солей різних типів
А. Нормальних (середніх):
3KOH + H3PO4 = K3PO4 + 3H2O
Основу й кислоту взято для взаємодії в стехіометричних кількостях (тобто вони реагують одна з одною без залишку).
Завдання 1. Допишіть рівняння реакцій.
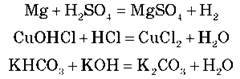
Б. Кислих:
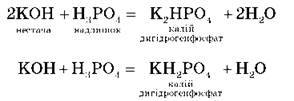
Для одержання кислих солей кислота береться в надлишку, а основа – у нестачі.
В. Основних:
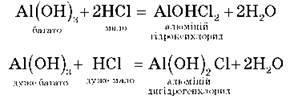
Для одержання основних солей основа береться в надлишку, а кислота – у нестачі.
3. Генетичний зв’язок класів неорганічних сполук
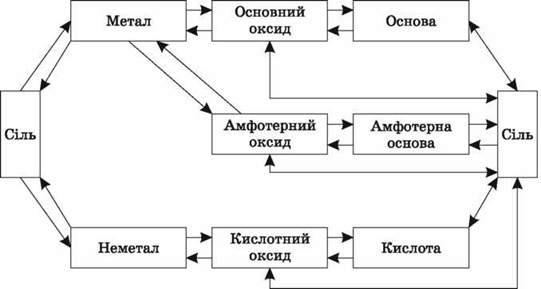
Завдання 2 (робота в парах). Здійсніть перетворення за схемами.
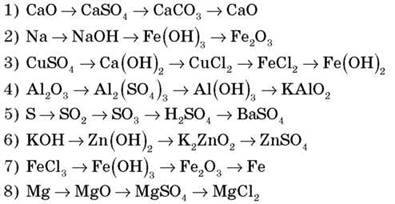
IV. Підбиття підсумків уроку
Учні разом з учителем перевіряють правильність заповнення схеми, виправляють помилки. Учитель підбиває підсумки уроку, оцінює, заохочує найбільш активних учнів.
V. Домашнє завдання
Повторити основні класи неорганічних сполук.