Озон – Елементи VIA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.3. Елементи VIA Групи
9.3.4. Озон
Озон O3 – це ще одна алотропна модифікація Оксигену. Відносна молекулярна маса – 48, молярна маса – 48 г/моль. Це газ зі своєрідним, різким “металічним” запахом, дуже отруйний. Озон – сильніший окисник, ніж кисень.
Поширеність у природі
Близько 90% природного озону міститься в стратосфері на висоті 12-50 км (максимальна густина –
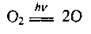
І під час його розкладання, фотолізу:
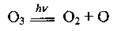
Іще 10% атмосферного озону містить тропосфера – нижній шар
Є озон і у хвойних лісах (7 · 10-6 %), де він утворюється внаслідок окиснення смолистих речовин.
Властивості озону
Озон – нестійка речовина. При його розкладанні утворюється атомарний Оксиген, що зумовлює високу окислювальну активність озону. Озон не окислює лише золота Аu, платини Pt та іридію Іr.
З деякими металами озон утворює озоніди:
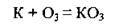
Якісна реакція на озон
Озон не окислює хлорид – і бромід-іонів, однак окислює іодид-іони:
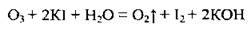
Добування озону
У лабораторії озон одержують з кисню (чи повітря) за допомогою озонатора під дією “тихих” (без іскри) електричних розрядів:
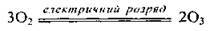
У природі озон утворюється під час грози, а в стратосфері – під дією ультрафіолету сонячного випромінювання.
Застосування озону
1. Знезараження повітря і питної води (озонування – процес менш шкідливий, ніж хлорування).
2. Дезінфекція приміщень4, одягу, стерилізація перев’язувального матеріалу в медицині.
3. Відбілювання паперу.
4. Отримання різноманітних речовин у хімічній промисловості і в лабораторії (камфори, ваніліну, моно – і дикарбонових кислот).
5. Озонування стічних вод хімічних підприємств (перш за все у випадку фенольних і ціанідних забруднень).
______________________________________________________________
1 Тут його концентрація циклічно коливається відповідно до 11-річного циклу активності Сонця.
2 Як уже згадувалось, уся атмосфера, товщина якої сягає 100 км, приведена до н. у., була би завтовшки 8 км.
3 Надалі він приєднується до молекули кисню, утворюючи молекулу озону.
4 При використанні бактерицидної УФ-лампи мікроорганізми гинуть не тільки безпосередньо під дією ультрафіолетового випромінювання, а й унаслідок дії озону, який утворюється в приміщенні під час роботи такої лампи.
Застереження (!): такі лампи не можна використовувати для засмаги, дивитись на них (під час роботи).
