Періодичні властивості атомів
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ
§ 2.10. Періодичні властивості атомів
Такі властивості атомів, як розмір, енергія іонізації, спорідненість до електрона, електронегативність, ступінь окиснення, пов’язані з електронною конфігурацією атома. В їх зміні зі збільшенням порядкового номера елемента простежується періодичність.
Атоми не мають чітко визначених меж, що зумовлено хвильовою природою електронів. У розрахунках
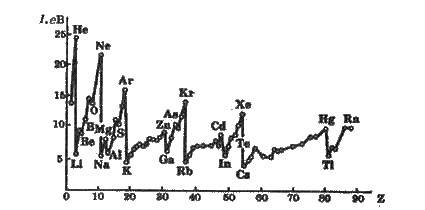
Рис. 2.6. Зміна енергії іонізації атома залежно від порядкового номера елемента
Радіус атома – важлива його характеристика. Чим більший атомний радіус, тим слабкіше утримуються зовнішні електрони. І навпаки, зі зменшенням атомного радіуса електрони притягуються до ядра сильніше.
У періоді атомний радіус взагалі зменшується зліва направо. Це пояснюється збільшенням
Енергія іонізації – це енергія, необхідна для відривання найслабкіше зв’язаного електрона від атома. Вона звичайно виражається в електрон-вольтах. Внаслідок відривання електрона від атома утворюється відповідний катіон.
Енергія іонізації для елементів одного періоду зростає зліва направо зі збільшенням заряду ядра. В підгрупі вона зменшується зверху вниз внаслідок збільшення відстані електрона від ядра. Зміна енергії іонізації атомів зі збільшенням заряду ядра графічно зображена на рис. 2.6.
Енергія іонізації пов’язана з хімічними властивостями елементів. Так, лужні метали, енергія іонізації яких мала, мають яскраво виражені металічні властивості. Хімічна інертність благородних газів пов’язана з їхніми великими значеннями енергії іонізації. Атоми можуть не тільки віддавати, а й приєднувати електрони. При цьому утворюється відповідний аніон. Енергія, яка виділяється внаслідок приєднання до атома одного електрона, називається спорідненістю до електрона. Звичайно, спорідненість до елек трона, як і енергію іонізації, виражають в електрон-вольтах. Величина спорідненості до електрона відома не для всіх елементів; вимірювати її досить важко. Найбільші значення цих величин мають галогени, в яких на зовнішньому рівні розташовано по 7 електронів. Це свідчить про підсилення неметалічних властивостей елементів у міру наближення до кінця періоду.
Визначення електронегативності дав американський учений Л. Полінг у 1932 р. Він також запропонував і першу шкалу електронегативності. За Полінгом, електронегативність – це здатність атома в сполуці притягувати до себе електрони.
Маються на увазі валентні електрони, тобто електрони, які беруть участь в утворенні хімічного зв’язку. Очевидно, у благородних газів електронегативності немає, оскільки зовнішній рівень у їх атомах завершений і стійкий.
Для кількісної характеристики запропоновано прийняти за міру електронегативності енергію, яка дорівнює арифметичній сумі енергії іонізації атома (l) і спорідненості електрона (E), тобто
X = l + Е, (2.3)
Де X – електронегативність атома, а отже, і елемента.
Як приклад визначимо X для флуору і літію. Із довідкових таблиць знаходимо, що lF = 17,42 еВ, EF = 3,62 еВ, lLі = = 5,39 еВ, ELі = 0,22 еВ (обчислено непрямим способом). Тоді ХF = 17,42 + 3,62 = 21,04 еВ, а ZLі = 5,39 + 0,22 = = 5,61 еВ.
Флуор має найбільше значення l + E, тому він є найбільш електронегативним елементом. Найменші значення електронегативності мають атоми лужних металів.
Звичайно електронегативність літію приймають за одиницю і порівнюють з нею електронегативність інших елементів. Тоді дістають прості й зручні для порівняння величини відносної електронегативності елементів (позначимо її через х):
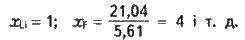
Нині широко використовують таблицю відносних електронегативностей, до якої увійшли останні дані про електронну будову атомів і їх радіуси (табл. 2.2).
Таблиця 2.2. Відносні електронегативності елементів
І | II | III | IV | V | VI | VII | VIII | ||
І | H 2,1 | He – | |||||||
II | Li 0,97 | Be 1,47 | В 2,01 | C 2,50 | N 3,07 | O 3,5 | F 4,10 | Ne – | |
III | Na 1,01 | Mg 1,23 | Al 1,74 | Si 1,47 | P 2,1 | S 2,6 | Cl 2,83 | Ar – | |
К 0,91 | Ca 1,04 | Sc 1,20 | Ті 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 | Co 1,70 | Ni 1,75 |
IV | Cu 1,75 | Zn 1,66 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr – | |
Rb 0,89 | Sr 0,99 | Y 1,11 | Zr 1,22 | Nb 1,23 | Mo 1,30 | Tc 1,36 | Ru 1,42 | Rh 1,45 | Pd 1,35 |
V | Ag 1,42 | Cd 1,46 | In 1,49 | Sn 1,72 | Sb 1,82 | Те 2,01 | L 2,21 | Xe – | |
Cs 0,86 | Ba 0,97 | La* 1,08 | Hf 1,23 | Та 1,33 | W 1,40 | Re 1,46 | Os 1,52 | Lr 1,55 | Pt 1,44 |
VI | Au 1,42 | Hg 1,44 | Ті 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 | Rn – | |
VII | Fr 0,86 | Ra 0,97 | Ac** 1,00 | * Лантаноїди 1,08-1,14 **Актиноїди 1,11-1,2 |
Слід зазначити, що значення відносних електронегативностей, які приводяться в різних книжках з хімії, дещо відрізняються. Це пояснюється тим, що їх розраховували різними методами, виходячи з певних припущень і догадок.
Зіставляючи значення електронегативностей елементів від францію (0,86) до флуору (4,10) (див. табл. 2.2), легко помітити, що відносна електронегативність підлягає періодичному закону: в періоді вона зростає зі збільшенням номера елемента, в групі – зменшується. Її значення є мірою неметапічності елементів. Очевидно, чим більша відносна електронегативність, тим сильніше елемент виявляє неметалічні властивості.
З табл. 2.2 також видно, що неметали характеризуються великою відносною електронегативністю, а метали – невеликою. Під час хімічної взаємодії елементів електрони зміщуються від атома з меншою до атома з більшою відносною електронегативністю.
Про ступінь окиснення див. § 3.9.