Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва у світлі уявлень про будову атома
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 5. Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва у світлі уявлень про будову атома
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати сучасне формулювання періодичного закону; будову короткої і напівдовгої форм періодичної системи хімічних елементів Д. І. Менделєєва; сучасні уявлення про періодичність властивостей елементів за будовою атомів;
Характеризувати хімічні елементи за їх місцем у періодичній системі.
До
Однак скласти таблицю, яка включала б усі відомі 63 елементи, згрупувати їх у кілька горизонтальних рядів таким чином, щоб у вертикальні колонки потрапили елементи, подібні за хімічними властивостями, вдалося лише Д. І. Менделєєву. Він відкрив періодичний закон (1869), коли
Тільки з виявленням фізичного змісту порядкового (атомного) номера елемента (1912 р.) і відкриттям будови атомного ядра (1932 р.) стало зрозуміло, що елементи у періодичній системі розміщені в порядку збільшення позитивного заряду їх атомних ядер. Тому сучасне формулювання періодичного закону таке:
Властивості елементів та утворених ними сполук перебувають у періодичній залежності від величини зарядів ядер їх атомів.
Щодо періодичної системи хімічних елементів Д. І. Менделєєва, то нині відомо понад 500 варіантів її графічного зображення. Серед них найбільш популярні так звані коротка і напівдовга форми, які доповнюють одна одну і в цілому ідентичні, оскільки в обох формах хімічні

Д. І. Менделєєв (1834-1907)
Повторення та поглиблення теоретичних питань курсу хімії основної школи лементи за структурою незбуджених атомів поділяються на природні сукупності. Це відображено у вигляді горизонтальних і вертикальних рядів – періодів і груп.
Останнім часом напівдовга форма стала домінуючою, оскільки краще узгоджується з будовою атомів елементів. Напівдовга форма періодичної системи так само має сім періодів, але кожен з них займає лише одну горизонталь, на два ряди не поділяється. Ліворуч розміщуються s-елементи, в атомах яких заповнюються s-орбіталі. Це лужні та лужноземельні елементи, а також Гідроген і Гелій (див. табл. на форзаці). Праворуч – р-елементи, в атомах яких заповнюються р-орбіталі. В середній частині розміщуються так звані перехідні елементи, в атомах яких заповнюються d-орбіталі передзовнішнього шару. Родини лантаноїдів та актиноїдів – це f-елементи. У їх атомах заповнюється третій ззовні шар. Ці родини в короткій і напівдовгій формах виносять за межі таблиці.
Напівдовга форма періодичної системи хімічних елементів включає
16 руп – 8А і 8Б. У групах А містяться s – та р-елементи, в їх атомах електрони зовнішнього енергетичного рівня є валентними. В атомах елементів груп Б до валентних, окрім зовнішніх електронів, належать також електрони d-орбіталей, що заповнюються. Отже, причина подібності властивостей хімічних елементів полягає в повторюваності будови зовнішнього енергетичного рівня їх атомів.
Число валентних електронів відповідає номеру групи, в якій перебуває елемент, і вищому ступеню окиснення атомів елемента. Наприклад, усі елементи VІІА групи мають по 7 валентних електронів, електронна конфігурація атомів яких ns2np5, де n – номер періоду, в якому розміщений елемент, і, отже, номер зовнішнього енергетичного рівня. Кількість валентних електронів 7 відповідає номеру групи і вищому ступеню окиснення елементів +7 (за винятком найелектронегативнішого Флуору, який не виявляє позитивного ступеня окиснення).
Отже, місце елемента у періодичній системі прямо пов’язане з електронною конфігурацією його атома. Тобто за місцем елемента у періодичній системі можна скласти електронну конфігурацію атома. Проте справедливим є й зворотне твердження: за електронною конфігурацією можна визначити елемент.
Наприклад, елемент з електронною конфігурацією атома 1s22s22p63s23p63d104s2 – Цинк (2 + 2 + 6 + 2 + 6 + 10 + 2 = 30).
Якщо зазначено конфігурацію тільки валентних електронів, наприклад 4s24p3, то можна розмірковувати так: оскільки атом має четвертий енергетичний рівень, то елемент міститься в 4-му періоді; оскільки валентних електронів 5, то – в п’ятий групі; оскільки в атомі заповнюється р-підрівень, то 3й-орбіталі вже заповнені. Отже, елемент належить до А групи – VA, тобто це Арсен.
Коротко про головне
Властивості хімічних елементів перебувають у періодичній залежності від величини позитивного заряду ядра їх атомів. Причина подібності властивостей груп елементів полягає у періодичній повторюваності конфігурації валентних електронів. Номер зовнішнього енергетичного рівня атома відповідає номеру періоду, в якому розміщений елемент. Число валентних електронів, як правило, відповідає номеру групи, в якій міститься елемент, та його вищому ступеню окиснення у сполуках.
Металічні та неметалічні елементи. Ви вже знаєте, що для атома найбільш енергетично вигідною є повністю заповнена електронна оболонка, – як у атомів інертних газів. Тому атоми інших елементів намагаються завершити свою електронну конфігурацію до оболонки інертного елемента ns2np6. Для цього атоми або віддають електрони із зовнішнього енергетичного рівня (окиснення), або приєднують електрони (відновлення), яких не вистачає до повного заповнення орбіталей зовнішнього рівня.
Кількість енергії, необхідної для відриву від атома найбільш слабкозв’язаного з ним електрона, називається енергією йонізації (у перерахунку на 1 моль). Чим вона менша, тим легше атом віддає електрон, тим більше виражені його відновні властивості (мал. 9).
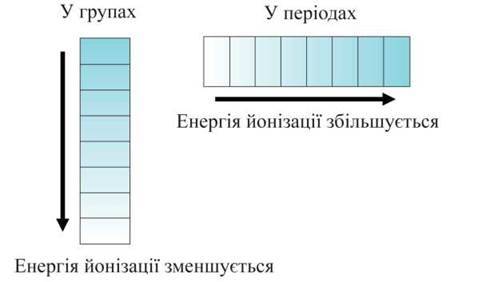
Мал. 9. Схема зміни енергії йонізації хімічних елементів
Властивості неметалічних елементів характеризують за спорідненістю до електрона, тобто енергетичним ефектом приєднання електрона до атома (у перерахунку на 1 моль). Чим вища спорідненість до електрона, тим міцніше атом утримує чужий електрон, тим сильніше виражені його окиснювальні властивості.
Радіус атома. Зрозуміло, що атоми не мають суворо визначених меж через корпускулярно-хвильовий характер електрона. Тому абсолютне значення радіуса атома визначити неможливо. Ось чому за радіус атома умовно приймають відстань від ядра до найбільш віддаленого від нього електрона.
Спостерігається періодичність у зміні атомних радіусів. Так, у періодах зі збільшенням числа електронів на зовнішньому енергетичному рівні збільшується їх сумарний негативний заряд. Електрони сильніше притягаються до позитивно зарядженого ядра, і атом ніби стискається, тобто його радіус зменшується (мал. 10).
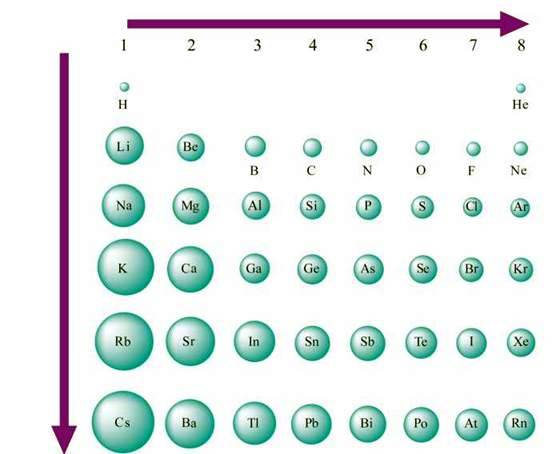
Мал. 10. Порівняльні величини атомних радіусів деяких елементів
Зі збільшенням атомного номера елементів радіуси його атомів в А групах, як правило, збільшується внаслідок збільшення числа енергетичних рівнів. Проте збільшення заряду ядра при цьому викликає протилежний ефект. Тому збільшення атомних радіусів зі збільшенням головного квантового числа n (номера періоду) відносно невелике, а в деяких випадках, наприклад у р-елементів ІІІА групи, значення радіуса атома Al більше, ніж у Ga.
Електронегативність елемента – це здатність атома елемента в хімічній сполуці притягувати до себе електрони. Чим більше електронегативність атома, тим сильніше він притягує спільну електронну пару (через що вона зміщується в бік більш електронегативного елемента), тим яскравіше виявлені в нього неметалічні властивості.
Уперше шкалу електронегативностей елементів розробив американський учений Л. Полінг (1932). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі: в періодах їх електронегативність зростає зліва направо, а в групах – знизу вгору.
Як пояснити цю закономірність?
У періодах у міру зростання зарядів ядер атомів число валентних електронів збільшується, радіус атомів зменшується, а спорідненість до електрона зростає. Отже, електронегативність збільшується.

Л. К. Полінг (1901-1994)
Американський фізик і хімік, громадський діяч. Праці зі структури білків, імунохімії, молекулярної генетики. Виступав проти випробувань ядерної зброї. Нобелівська премія з хімії (1954), Нобелівська премія миру (1962), Міжнародна Ленінська премія (1970). Золота медаль ім. Ломоносова АН СРСР (1977)
У групах А навпаки: радіус атомів збільшується, зв’язок валентних електронів з ядром послаблюється, і приєднання нових електронів ускладнюється, тобто електронегативність зменшується.
Найбільшу електронегатив – ність мають галогени, особливо Флуор; найменшу – лужні елементи. Інертні елементи електро – негативності не мають.
Коротко про головне
Властивості хімічних елементів змінюються періодично зі зростанням зарядів ядер атомів. Причина зміни властивостей полягає в тому, що так само періодично змінюється число валентних електронів у атомах.
У періодах зі збільшенням зарядів ядер атомів елементів посилюються їх неметалічні властивості, а металічні – послаблюються, відповідно окиснювальні властивості посилюються, а відновні – послаблюються; електронегативність елементів посилюється, а радіуси атомів зменшуються.
У групах зі збільшенням зарядів ядер атомів елементів металічні властивості посилюються, а неметалічні – послаблюються, відповідно відновні властивості атомів посилюються, а окиснювальні – послаблюються; електронегативність елементів зменшується, а радіуси атомів збільшуються.