Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ
Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
Полярність ковалентного зв’язку
У молекулах водню, фтору й фтороводню між атомами утворюється ковалентний зв’язок за рахунок утворення спільної електронної пари. Атоми різних хімічних елементів здатні притягувати валентні електрони інших атомів. Це явище називають електронегативністю. Однакові атоми однаково притягують
Атоми Гідрогену та Флуору притягують електрони по-різному. У Флуора електронегативність більша, ніж у Гідрогену, тому атоми Флуору дужче притягують, спільну електронну пару, аніж атоми Гідрогену. Це призводить до зміщення спільної електронної пари в бік атома Флуору й збільшення на ньому електронної густини. Спільна
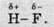
Літера δ означає, що заряд на атомах менший від заряду електрона й має нецілочисельне значення. Заряд на атомі Гідрогену точно дорівнює заряду на атомі Флуору, але з іншим знаком, і в сумі заряд молекули дорівнює нулю, тобто молекула залишається електронейтральною.
Ковалентний зв’язок, утворений між атомами різних елементів, називають полярним (тому що в молекулі з’являються полюси електричного заряду). У ковалентному полярному зв’язку спільна електронна пара зміщена до того атома, який дужче притягує електрони, тобто до атома з більшою електронегативністю. Чим сильнішим є це зміщення, тим більша полярність зв’язку. Чим більшою є різниця електронегативностей, тим сильніше спільна електронна пара зміщена до більш електронегативного атома й тим більша полярність ковалентного зв’язку.
Для того щоб зв’язок залишався ковалентним, різниця електронегативностей не повинна перевищувати 2 (за шкалою Полінга).
Довжина зв’язку
Відстань між ядрами зв’язаних атомів називають довжиною зв’язку. Атоми зближаються на таку відстань, при якій досягається найбільше перекривання їхніх електронних орбіталей, а енергія молекули стає мінімальною. Довжина зв’язку співмірна з розмірами атомів і зазвичай становить 0,1-0,2 нм.
Довжина зв’язку залежить від радіуса атомів. Чим більші радіуси атомів, тим більшою є довжина зв’язку між ними. Так, у ряді галогенів зі збільшенням порядкового номера збільшується радіус атомів унаслідок того, що в електронній оболонці атомів галогенів збільшується число енергетичних рівнів. Тому в ряді галогеноводнів збільшується довжина зв’язку: від найменшої у фтороводню до найбільшої в йодоводню.
Довжина зв’язку залежить від кратності зв’язку (числа спільних електронних пар між двома атомами). Чим більшою є кратність зв’язку, тим менша відстань між атомами. В атомів хімічних елементів другого періоду радіуси атомів приблизно однакові, але в ряді фтор F2 – кисень О2 – азот N2 довжина зв’язку в молекулах істотно зменшується, тому що в молекулі фтору одинарний зв’язок, кисню – подвійний, а азоту – потрійний.
Енергія зв’язку
Енергія зв’язку – це кількість енергії, необхідна для розриву 1 моль однакових зв’язків. Енергія зв’язку (Е) вимірюється в кДж/моль.
Енергія зв’язку залежить, у першу чергу, від природи атомів, що утворюють зв’язок, а також від довжини зв’язку та її кратності. Чим меншою є довжина зв’язку, тим ближче розташовані атоми й тим сильніше вони взаємодіють один з одним, тим вища енергія їхнього зв’язку. У молекулах галогеноводнів від фтороводню до йодоводню довжина зв’язку збільшується, значить енергія зв’язку зменшується: від найбільш сильної у фтороводню до найбільш слабкої в йодоводню.
Енергія зв’язку залежить також від його кратності: потрійний зв’язок міцніший за подвійний, а подвійний міцніший, ніж одинарний.