Поняття про періодичну систему хімічних елементів Д. І. Менделєєва
Тема 1
ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ
Урок 7
Тема. Поняття про періодичну систему хімічних елементів Д. І. Менделєєва
Цілі уроку: ознайомити учнів з будовою періодичної системи хімічних елементів Д. І. Менделєєва; сформувати початкові навички визначення положення хімічного елемента в періодичній системі; продовжити знайомство із символами й назвами елементів за сучасною українською номенклатурою.
Тип уроку: комбінований.
Форми роботи: фронтальна бесіда, хімічний диктант, розповідь, самостійна робота.
Обладнання: періодична
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання, повторення вивченого матеріалу
1. Хімічний диктант за назвами й хімічними символами елементів
2. Робота біля дошки
Перевіряємо будову атома.
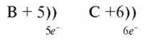
ІІІ. Вивчення нового матеріалу
1. Актуалізація опорних знань
– Які відомості можна знайти про хімічний елемент у періодичній системі?
– Хімічний символ;
– назву;
– порядковий номер;
– атомну масу;
– будову атома.
2. Знайомство з будовою періодичної системи Д. І. Менделєєва
У
У першій половині ХІХ століття відкриття нових хімічних елементів поставило перед хімією проблему класифікації хімічних елементів, оскільки поділ на металічні й неметалічні був явно неповним.
У пошуках основних властивостей для класифікації хімічних елементів багато вчених дійшли висновку, що це може бути атомна маса.
Німецький учений Й. Деберейнер (1829) запропонував класифікувати елементи на тріади (по три елементи) за ознакою, коли атомна маса середнього елемента в тріаді дорівнює середньому арифметичному атомних мас крайніх елементів. Але далеко не всі атоми можна було описати такими тріадами. Англійський хімік Дж. Ньюлендс (1869) розмістив елементи в ряд у міру збільшення їх атомних мас і дійшов висновку, що кожен восьмий елемент повторює властивості першого. Але вчений не зміг науково обгрунтувати таке положення. Російський учений Д. І. Менделєєв помітив періодичну зміну елементів і зумів пояснити залежність між величиною атомної маси елемента і властивостями простих і складних речовин. Цю закономірність було покладено в основу структури таблиці класифікації хімічних елементів, що відома як періодична система хімічних елементів Д. І. Менделєєва.
Ця система хімічних елементів сьогодні відома в усьому світі й використовується ученими всіх країн. У ній положення кожного хімічного елемента описується точною адресою: порядковим номером, номером групи й періоду, на перетинах яких він знаходиться.
Поширено два варіанти таблиці: короткий і довгий. Розгляньмо ці варіанти. Елементи розташовуються в порядку зростання атомних мас і мають порядковий номер. Складений ряд елементів Д. І. Менделєєв поділив на короткі ряди, що починалися характерними металами (лужні метали: Li, Na, K, Rb, Cs, Fr) і закінчувалися типовими неметалами (галогени: F, Cl, Br, I, At). Пізніше було відкрито інертні елементи (благородні гази: He, Ne, Ar, Kr, Xe, Rn), що завершують кожен ряд. Так сформувалися горизонтальні ряди – періоди.
Періоди – це горизонтальні ряди хімічних елементів. На сьогодні відомо сім періодів.
І, ІІ, ІІІ – малі періоди, що складаються з одного ряду елементів.
IV, V, VI, VII – великі періоди, що складаються з двох рядів елементів і можуть мати навіть більш ніж два ряди.
Після розташування періодів один під одним утворилося вісім груп.
Група – вертикальний стовпець елементів. У них зібрані елементи, що мають подібні хімічні властивості, хоча вони можуть відрізнятися за фізичними властивостями.
Усередині групи елементи поділяються на головну і побічну групу.
Наприклад, He знаходиться в I періоді, VIII групі, головній підгрупі.
O – II період, VI група, головна підгрупа.
S – III період, VI група, головна підгрупа.
Особливу будову має VIII група. її головна підгрупа – інертні гази, а побічна складається з трьох тріад, що об’єднуються в природні родини:
Ферум Fe, Кобальт Co, Нікель Ni;
Рутеній Ru, Родій Rh, Палладій Pd;
Осмій Os, Іридій Ir, Платина Pt.
У нижній частині системи винесено два ряди по 14 елементів. Вони об’єднуються в природні родини “лантаноїди” й “актиноїди”. Розміщення елементів по групах і родинах полегшує їх вивчення. Знаючи будову і властивості одного з них, можна передбачити будову і властивості інших, що входять до цієї групи.
ІV. Закріплення нового матеріалу
1. Назвіть період і групу, в якій знаходяться атоми:
C – II період, IV група, головна підгрупа;
Al – III період, III група, головна підгрупа;
F – II період, VII група, головна підгрупа;
Fe – IV період, VIII група, побічна підгрупа;
Cu – IV період, I група, побічна підгрупа;
2. Тепер виконаємо завдання навпаки: ви по ланцюжку називаєте ім’я учня і положення атома в періодичній системі, а учень, чиє ім’я ви назвали, дає назву атома і складає нове завдання.
Наприклад:
– II період, IV група, головна підгрупа – Si Силіцій;
– II період, V група, головна підгрупа – N Нітроген.
3. Ми вже знаємо, що порядковий номер дорівнює заряду ядра атома, а кількість електронів в атомі дорівнює порядковому номеру. За номером періоду визначається кількість енергетичних рівнів.
Згадаймо, як ми записували будову атома на прикладі:
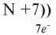
Порядковий номер – 7;
Заряд ядра – +7;
Електронів – 7.
II період, два енергетичні рівні.
Порядковий номер – 8;
Заряд ядра – +8,
Електронів – 8.
Прокоментуйте схему будови атома Оксигену.
II період, два енергетичні рівні, на першому два електрони, на другому – шість електронів.
4. На додаток до вивчених елементів запишемо назви ще десятьох елементів, які необхідно вивчити до наступного уроку.
5. Заповніть пропущені клітинки в таблиці.
Хімічний елемент | Al | |
Назва | Нітроген | |
Порядковий номер | 9 | |
Період | II | III |
Група | III | I |
Підгрупа | Головна | Побічна |
V. Підбиття підсумків
Періодична система хімічних елементів Д. І. Менделєєва – унікальний довідковий посібник хіміка, що містить відповіді на багато питань про будову атомів, властивості хімічних елементів та їх сполук.
VI. Домашнє завдання
Прочитати параграф і відповісти на запитання.
Творче завдання. Підготувати повідомлення про історію виникнення назв хімічних елементів (одну-дві на вибір).