ПРАКТИЧНА РОБОТА № 2 “РОЗВ’ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ”
ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ
УРОК 15. ПРАКТИЧНА РОБОТА № 2 “РОЗВ’ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ”
Цілі: закріпити знання про хімічні властивості алюмінію, заліза та їх сполук; уміти експериментально доводити амфотерність алюмінію та його сполук, розрізняти сполуки Алюмінію, Феруму(ІІ) та Феруму(ІІІ), перевірити практичні навички учнів у розв’язанні експериментальних задач.
Обладнання: реактиви для проведення дослідів.
Тип уроку: практична робота.
Форми роботи: фронтальна бесіда, робота в групах,
ХІД УРОКУ
I. Організація класу
II. Оголошення теми й мети
III. Актуалізація опорних знань
Фронтальна бесіда “Мікрофон”
1. Які властивості мають сполуки Алюмінію?
2. Що таке амфотерність?
3. З якими речовинами можуть реагувати алюміній і залізо?
4. Які ступені окиснення буде проявляти Алюміній, Ферум?
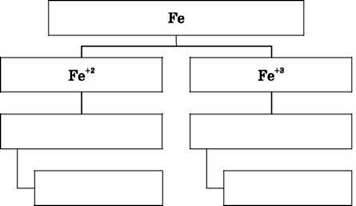
5. Заповніть схему сполук заліза:
IV. Навчальна частина
Робота в групах
1. Запишіть рівняння реакції добування алюміній гідроксиду дією натрій гідроксиду на будь-яку сіль алюмінію. Алюміній гідроксид
2. Запишіть рівняння реакції взаємодії алюміній гідроксиду з хлоридною кислотою й калій гідроксидом.
3. Якісною реакцією на залізо зі ступенями окиснення +2 та +3 є також реакція їх солей з лугами. Запишіть рівняння реакцій ферум(ІІ) і ферум(ІІІ) хлоридів з будь-яким лугом. Осади гідроксидів Феруму(ІІ) та Феруму(ІІІ) різняться за кольором. Fe(OH)2 – осад зеленкуватого кольору, який з часом буріє. Fe(OH)3 – осад бурого кольору.
V. Практична робота
Інструктивна картка
Тема. Розв’язування експериментальних задач
Цілі: навчитися розв’язувати експериментальні задачі, експериментально добувати та розпізнавати сполуки Алюмінію та Феруму, закріпити вміння складати рівняння реакцій добування сполук Алюмінію та Феруму, вміння складати рівняння реакцій у іонному вигляді, практично проводити експериментальні завдання.
Із правилам техніки безпеки ознайомлений(на), зобов’язуюсь їх виконувати ____________________________ підпис.
ХІД РОБОТИ
1. До 1 мл розчину алюміній сульфату долийте трохи по краплях розчину натрій гідроксиду. Що спостерігаєте? _____________________
________________________________________________________________________________________
Складіть рівняння реакції в молекулярному та іонному вигляді.
________________________________________________________________________________________
2. Розподіліть уміст пробірки на дві частини. До першої долийте трохи розчину хлоридної кислоти. Що спостерігаєте? ________________
________________________________________________________________________________________
Складіть рівняння реакції в молекулярному та іонному вигляді.
________________________________________________________________________________________
________________________________________________________________________________________
3. До другої частини долийте по краплях розчин натрій гідроксиду. Що спостерігаєте? ______________________________________
________________________________________________________________________________________
Запишіть рівняння реакції.
________________________________________________________________________________________
________________________________________________________________________________________
4. У двох пробірках дано розчини ферум(ІІ) сульфату й ферум(ІІІ) сульфату. У кожну пробірку долийте трохи розчину натрій гідроксиду.
Що спостерігаєте? _______________________________________________________________________________________
________________________________________________________________________________________
Складіть рівняння реакцій у молекулярному та іонному вигляді. Зазначте колір утворених осадів.
1) _________________________________________________________________________
2) _________________________________________________________________________
Висновок:
Додаткове завдання
Здійсніть практично перетворення, запишіть рівняння реакцій.
І варіант.
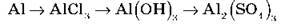
ІІ варіант.
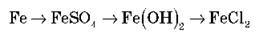
VI. Підбиття підсумків уроку
VII. Домашнє завдання