Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 23
Тема. Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
Цілі уроку: закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ.
Тип уроку: формування вмінь і навичок, урок-дослідження.
Форми роботи: лабораторна робота, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
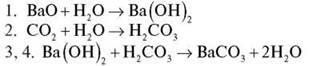
Робота з опорною схемою “Хімічні властивості основ”
– На основі знань про хімічні властивості основ заповнимо опорну схему “Хімічні властивості основ”.
– Згадаймо, яких правил необхідно дотримуватися в хімічній лабораторії.
(Звертаємося до таблиці “Правила техніки безпеки в кабінеті хімії”.)
III. Формування
Лабораторна робота № 4. Взаємодія розчинів лугів з кислотами
У дві пробірки наливаємо по 1 мл NaOH і по одній-дві краплі фенолфталеїну. Потім в одну з них по краплях додаємо хлоридну кислоту, у другу – сульфатну кислоту. Заносимо результати до протоколу.
Реагенти | Що спостерігаєте? | Рівняння реакції | Висновок |
NaOH | HCl | ||
NaOH | H2SO4 | ||
Cu(OH)2 | HCl |
Лабораторна робота № 5. Взаємодія нерозчинних основ з кислотами
Нам необхідно одержати купрум(ІІ) гідроксид. Як це зробити? Яку властивість основ для цього можна використати?
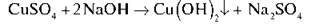
До одержаного осаду по краплях додаємо хлоридну кислоту.
– Які ознаки хімічної реакції спостерігаємо?
Запишіть результати досліду до протоколу.
Лабораторна робота № 6. Розкладання нерозчинних основ у процесі нагрівання
Нерозчинні основи за нагрівання розкладаються на оксид і воду. Перевіримо це на практиці.
Одержіть купрум(ІІ) гідроксид, закріпіть пробірку в пробірко-тримачі.
– Як правильно нагріти пробірку?
– В якій частині полум’я необхідно нагрівати пробірку? (У верхній, найбільш гарячій)
– Що спостерігаємо? Запишемо рівняння реакції:
Cu(OH)2 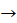 СuO + Н2O
СuO + Н2O
Укажіть тип реакції. (Реакція розкладу)
Висновок. З якими властивостями основ ми познайомилися на цьому уроці?
– Реакція нейтралізації.
– Розклад нерозчинних основ.
IV. Закріплення вивченого матеріалу
Керована практика
Завдання 1. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання алюміній гідроксиду масою 15,6 г.
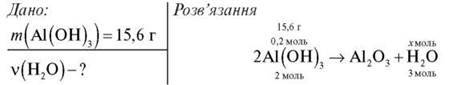
1) Обчислимо кількість речовини Аl(ОН)3 за формулою 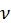 = m/M:
= m/M:
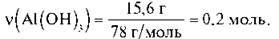
2) Складемо пропорцію й обчислимо кількість речовини води:
0,2 моль : 2 моль = х моль : 3 моль
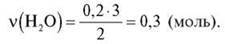
Відповідь: 0,3 моль.
Завдання 2. Здійсніть перетворення:
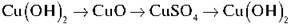
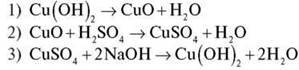
V. Домашнє завдання
Опрацювати відповідний параграф підручника, виконати завдання до нього.
Творче завдання. Підготувати повідомлення про використання основ.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Техніка безпеки під час роботи з лугами. Використання основ Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 25 Тема. Техніка безпеки під час роботи з лугами. Використання основ Цілі уроку: закріпити й поглибити знання про хімічні властивості класів неорганічних сполук на прикладі властивостей основ; розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ, виконання розрахунків за хімічними рівняннями; повторити правила техніки […]...
- Фізичні властивості основ. Хімічні властивості лугів Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 22 Тема. Фізичні властивості основ. Хімічні властивості лугів Цілі уроку: ознайомити учнів з фізичними властивостями основ; закріпити знання про класифікації основ на розчинні й нерозчинні; розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі основ; показати дію лугів на індикатори; розвивати навички складання рівнянь хімічних реакцій […]...
- Основи, їх склад і назви. Класифікація основ Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 15 Тема. Основи, їх склад і назви. Класифікація основ Цілі уроку: розширити знання про класифікацію й номенклатуру неорганічних речовин на прикладі основ; розвивати вміння й навички складати формули неорганічних сполук за валентністю на прикладі основ, складати назви речовин за сучасною українською номенклатурою, розпізнавати класи неорганічних речовин. Тип уроку: […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- РЕАКЦІЯ НЕЙТРАЛІЗАЦІЇ – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія – універсальний довідник ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК РЕАКЦІЯ НЕЙТРАЛІЗАЦІЇ У результаті взаємодії еквівалентних кількостей кислоти і основи утвориться нейтральний розчин солі, тому така реакція називається реакцією нейтралізації. Кислота може бути нейтралізована не тільки основою, але й основним оксидом: Аналогічно луг нейтралізується кислотним оксидом: У всіх реакціях нейтралізації продуктами є сіль і вода. Під час […]...
- Поширення солей у природі та їх практичне значення Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 27 Тема. Поширення солей у природі та їх практичне значення Цілі уроку: систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солей; показати поширення солей у природі, їх практичне значення. Тип уроку: поглиблення й систематизація знань. Форми роботи: лабораторна робота, навчальний міні-семінар, робота з […]...
- Хімічні властивості основ – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімічні властивості основ Луги Нерозчинні гідроксиди Змінюють забарвлення індикаторів Взаємодіють із кислотами з утворенням солі й води (реакція нейтралізації): 2KOH + H2SO4 → K2SO4 + 2Н2O Взаємодіють із кислотами з утворенням солі й води (реакція нейтралізації): Fe(OH)2 + H2SO4 […]...
- Хімічні властивості кисню. Реакція сполучення. Поняття про оксиди ТЕМА 2. ПРОСТІ РЕЧОВИНИ МЕТАЛИ І НЕМЕТАЛИ Урок 2. Хімічні властивості кисню. Реакція сполучення. Поняття про оксиди Цілі: закріпити знання про способи добування кисню, його фізичні властивості, реакцію розкладу, каталізатор; вивчити хімічні властивості кисню на прикладах взаємодії з фосфором, вуглецем, сіркою; дати поняття про реакції сполучення, горіння, оксиди. Обладнання: таблиця “Типи хімічних реакцій”, кисень у […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- Проведення титрування – Титрування кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація 3.2. Титрування кислот і основ Проведення титрування Для визначення концентрації кислоти або лугу потрібне таке приладдя: – піпетка для відмірювання певного об’єму кислоти або основи невідомої концентрації; – бюретка для вимірювання розчину відомої концентрації; – Колба Ерленмейера (зі зразком) для розміщення відміряного об’єму розчину, що визначається, невідомої концентрації. Після додавання […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Електролітична дисоціація кислот, основ, солей у водних розчинах Тема 1 РОЗЧИНИ Урок 12 Тема уроку. Електролітична дисоціація кислот, основ, солей у водних розчинах Цілі уроку: поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей; формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; уточнити визначення кислот, основ і солей у світлі теорії електролітичної дисоціації. Тип уроку: засвоєння […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Загальні способи одержання оксидів, основ, кислот, солей Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 34 Тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх взаємозв’язок з генетичним зв’язком класів неорганічних сполук. Тип […]...
- Енергетика хімічних реакцій. Тепловий ефект реакції – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.4. Енергетика хімічних реакцій. Тепловий ефект реакції Як відомо із закону збереження енергії, енергія не виникає з нічого і не зникає безслідно. Речовини, що вступають у хімічну реакцію (реагенти), мають певний запас енергії (внутрішньої енергії). Під час хімічної реакції руйнуються […]...
- Водневий показник розчинів слабких кислот і основ – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Водневий показник розчинів слабких кислот і основ Оскільки при протолізі кислоти чи основи утворюється рівна кількість позитивних і негативних іонів, їхня концентрація буде однаковою: Якщо в даних рівняннях прологарифмувати значення концентрацій іонів (Н3О+) і (ОН-), то одержимо значення pH розчину кислоти або значення рОН […]...
- Крохмаль. Будова крохмалю. Хімічні властивості: гідроліз, реакція з йодом II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 46 Тема уроку. Крохмаль. Будова крохмалю. Хімічні властивості: гідроліз, реакція з йодом Цілі уроку: розширити знання учнів про високомолекулярні органічні сполуки, їх поширення в природі, будову та властивості на прикладі природних полімерів полісахаридів – крохмалю; розвивати знання учнів про хімічну будову високомолекулярних органічних сполук на прикладі полімерної […]...
- Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію I СЕМЕСТР Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.) УРОК 9 Тема уроку. Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію Цілі уроку: ознайомити зі складом, особливостями будови молекули й фізичними властивостями амоніаку, розчинністю амоніаку у воді й дією індикаторів на розчин, особливостями взаємодії амоніаку з водою й кислотами; формувати вміння […]...
- НАГРІВАННЯ МЕДУ НАГРІВАННЯ МЕДУ – проводиться у виняткових випадках, тому що після підігрівання він втрачає частину своїх корисних якостей. При кип’ятінні меду відбувається розкладання цукрів, що містяться в ньому, з виділенням води й утворенням карамеланів. Карамелізований мед набуває неприємного запаху і смаку, змінює колір (темнішає). При вапняній реакції карамелізований мед утворює каламуть. Цей мед не можна згодовувати […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Проміжне оцінювання з теми “Основні класи неорганічних сполук” Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 31 Тема. Проміжне оцінювання з теми “Основні класи неорганічних сполук” Цілі уроку: узагальнити й систематизувати знання учнів про властивості класів неорганічних сполук, їх генетичний зв’язок; визначити рівень навчальних досягнень з теми. Тип уроку: проміжний контроль і коригування знань. Форми роботи: письмова контрольна робота. Обладнання: Періодична система хімічних елементів […]...
- Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 37 Тема. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання. Тип […]...
- Карбонатна кислота. Карбонати й гідрогенкарбонати. Якісна реакція на карбонат-іон ІІ семестр Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (продовження) УРОК 19 Тема уроку. Карбонатна кислота. Карбонати й гідрогенкарбонати. Якісна реакція на карбонат-іон Цілі уроку: формувати знання учнів про карбонатну кислоту як одну зі слабких неорганічних кислот; ознайомити з її фізичними й хімічними властивостями; поглибити знання про середні й кислі солі, їх взаємоперетворення на прикладі […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- ДОБУВАННЯ ТА ЗБИРАННЯ КИСНЮ. ПОНЯТТЯ ПРО КАТАЛІЗАТОРИ. РЕАКЦІЯ РОЗКЛАДУ № 1. Каталізаторами називають речовини, які прискорюють хімічні реакції інших речовин, але при цьому самі не витрачаються і не входять до складу утворених продуктів реакції. Тому їхні формули не пишуть ні в лівій, ні в правій частині рівнянь хімічних реакцій. Кисень добувають з розчину гідроген пероксиду Н2O2. Для прискорення реакції додають невелику кількість манган (IV) […]...
- ВАННА ДЛЯ НАГРІВАННЯ НОЖІВ ВАННА ДЛЯ НАГРІВАННЯ НОЖІВ – ємність, що використовується на пасіках при розпечатанні стільників (рис. 5). В. виготовляється зазвичай з металу (нержавіючої сталі, білої жерсті тощо) з таким розрахунком, щоб у неї можна було класти одночасно 2-4 ножі. Із будь-якого м’якого матеріалу у В. робляться підставки для ножів, щоб при необхідності вони знаходилися у воді, а […]...
- Целюлоза. Будова целюлози. Хімічні властивості: окиснення, гідроліз, естерифікація, термічне розкладання II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 47 Тема уроку. Целюлоза. Будова целюлози. Хімічні властивості: окиснення, гідроліз, естерифікація, термічне розкладання Цілі уроку: розширити знання учнів про полісахариди та їхні властивості на прикладі целюлози; порівняти будову, фізичні й хімічні властивості целюлози та крохмалю; ознайомити учнів з хімічними властивостями целюлози – окисненням, реакцією гідролізу, етерифікації, термічного […]...
- Нагрівання й переміщення повітря РОЗДІЛ ІІІ ЗЕМЛЯ – ПЛАНЕТА СОНЯЧНОЇ СИСТЕМИ ТЕМА 1 Земля як планета § 35. Нагрівання й переміщення повітря Вивчення параграфа допоможе вам: – дізнатися, чому з віддаленням від земної поверхні стає холодніше; – дослідити, як нагрівається повітря; – поглибити знання про особливості переміщення повітря. Нагрівання й рух повітря. Крізь прозоре повітря сонячні промені проходять і […]...
- Поняття про амфотерні основи Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 24 Тема. Поняття про амфотерні основи Цілі уроку: розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ; розширити знання учнів про властивості основ і кислот на прикладі амфотерних сполук; формувати вміння й навички складання рівнянь хімічних реакцій на прикладі амфотерних основ. Тип уроку: поглиблення […]...
- Типи хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.3. Типи хімічних реакцій Хімічні реакції класифікують за різними ознаками: – за фазовим станом середовища; – за типом перетворення реагентів; – за тепловим ефектом; – за ознакою зміни ступенів окиснення; – за оборотністю. Фазовий стан середовища Залежно від фазового стану […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Сульфати. Якісна реакція на сульфат-іон. Розв’язання розрахункових задач з обчислення маси (об’єму, кількості речовини) продукту реакції, якщо один з реагентів узято в надлишку I СЕМЕСТР Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.) УРОК 14 Тема уроку. Сульфати. Якісна реакція на сульфат-іон. Розв’язання розрахункових задач з обчислення маси (об’єму, кількості речовини) продукту реакції, якщо один з реагентів узято в надлишку Цілі уроку: розширити знання учнів про солі на прикладі властивостей сульфатів, їх застосування; ознайомити учнів з якісною […]...
- Естери. Жири. Мило. Реакція естерифікації. Склад, хімічна будова естерів. Гідроліз естерів II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 41 Тема уроку. Естери. Жири. Мило. Реакція естерифікації. Склад, хімічна будова естерів. Гідроліз естерів Цілі уроку: формувати знання учнів про естери; поглибити знання учнів про хімічні властивості кислот і спиртів на прикладі реакції естерифікації, показати практичне значення цієї реакції; вивчити умови зсуву хімічної рівноваги на прикладі реакції […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Розвиток понять “кислоти” й “основи” – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ Кислотами зазвичай вважають речовини, водні розчини яких мають такі властивості: – кислий смак; – розчиняють неблагородні метали, виділяючи водень; – розкладають карбонати (наприклад, вапняк) з виділенням карбон діоксиду; – змінюють забарвлення індикаторів. До основ відносяться речовини, водні розчини яких (луги) мають такі властивості: – мильні на дотик; […]...
- Хімічні властивості альдегідів. Реакція окиснення й відновлення. Одержання етаналю. Використання метаналю й етаналю II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 36 Тема уроку. Хімічні властивості альдегідів. Реакція окиснення й відновлення. Одержання етаналю. Використання метаналю й етаналю Цілі уроку: ознайомити учнів з хімічними властивостями альдегідів, пов’язаними з карбонільною групою, способами одержання альдегідів на прикладі оцтового альдегіду; визначити галузі використання альдегідів з огляду на їхні фізичні й хімічні властивості; […]...
- Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.2. Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин Атомно-молекулярне вчення – це сукупність аксіом і законів, що розглядають речовину, яка складається з атомів. Ось основні його положення: – усі речовини складаються з атомів. Молекули простих речовин складаються з […]...
- Хімічні реакції. Схеми реакцій, хімічні рівняння – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.1. Хімічні реакції. Схеми реакцій, хімічні рівняння Хімічними реакціями називають перетворення однієї чи декількох речовин, які відрізняються одна від одної складом чи будовою молекули, на інші. Речовини, які вступають у хімічні реакції, називають вихідними речовинами, або реагентами, а речовини, які […]...
- Хімічні властивості кислот. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 19 Тема. Хімічні властивості кислот. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот Цілі уроку: закріпити знання про хімічні властивості кислот на прикладі хлоридної кислоти; поглибити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот; розвивати навички експериментальної роботи з […]...
- Складання слів, основ і їхніх частин УКРАЇНСЬКА МОВА. ПІДГОТОВКА ДО ЗНО БУДОВА СЛОВА. СЛОВОТВІР Складання слів, основ і їхніх частин Поширеним способом словотвору є складання двох і більше слів, основ або їхніх частин. Різновиди способу складання: А) Складання слів: Школа, інтернат -> школа-інтернат; кіно, театр -> кінотеатр; Б) Складання основи слова зі словом: Жовтий і гарячий -> жовтогарячий; В) Складання основ: […]...