Розрахунки за рівняннями хімічних реакцій між розчином солі та металом
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
§ 53. Розрахунки за рівняннями хімічних реакцій між розчином солі та металом
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати суть і причини зміни маси пластинки в зазначених реакціях;
Розв’язувати задачі “на пластинку”.
Задачі такого типу засновані на закономірностях витискувального ряду металів. Як ви уже знаєте, показником порівняльної хімічної активності металів є їх місце у витискувальному ряді металів. Кожен з металів здатний витісняти (відновлювати) з розчинів
Задача. Залізну пластинку масою 50 г занурили в розчин мідного купоросу. Через певний час пластинку вийняли, висушили і зважили. Її маса дорівнювала 50,32 г. Обчисліть масу міді, що залишилася на пластинці, та масу заліза, яке перейшло в розчин.
Для того щоб навчитися розв’язувати задачі цього типу, треба зрозуміти, чому змінюється маса пластинки.
У розчині між залізом і купрум(ІІ) сульфатом відбувається хімічна реакція:
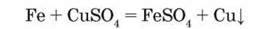
За рівнянням хімічної реакції один атом (1 моль атомів) Феруму заміщує один катіон
M(Cu) = 64 г/моль; m(1 моль Cu) = 64 г
M(Fe) = 56 г/моль; m(1 моль Fe) = 56 г
∆m(пласт.) = 64 г – 56 г = 8 г
З’ясувавши причину зміни маси пластинки, розв’яжемо задачу.
Р о з в ‘ я з а н н я
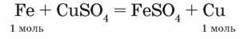
1. Обчислимо зміну маси пластинки за умови задачі:
∆m(пласт.) = m1(пласт.)
∆ m(пласт.) ∆m(пласт.) = 50,32 г – 50 г = 0,32 г
Далі задачу можна розв’язувати кількома способами. Розглянемо два з них.
І спосіб
2. Обчислимо зміну маси пластинки за рівнянням хімічної реакції. У реакції беруть участь залізо і мідь кількістю речовини 1 моль, тому,
За рівнянням, зміна маси пластинки дорівнює різниці мас заліза і міді кількістю речовини 1 моль кожного металу: ∆m(пласт.) = 64 г – 56 г = 8 г.
3. Обчислимо кількість речовини міді, що осіла на пластинці. Позначимо кількість речовини міді, що осіла на пластинці, х моль.
Відомо, що (за рівнянням реакції) на пластинці осідає мідь кількістю речовини 1 моль, різниця маси пластинки становить 8 г. За умовою задачі, осідає мідь кількістю речовини х моль, різниця маси дорівнює 0, 32 г.
1 моль Cu – 8 г, зміна маси пластинки; х моль Cu – 0,32 г, зміна маси пластинки.
Ця пропорційна залежність дає можливість скласти пропорцію:
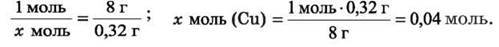
4. Обчислимо масу міді, що осіла на пластинці.
M(Cu) = M – n; m(Cu) = 64 г/моль – 0,04 моль = 2,56 г.
5. Обчислимо масу заліза, яке переходить у розчин:
N(Fe) = n(Cu) = 0,04 моль;
M(Fe) = M – n; m(Fe) = 56 г/моль – 0,04 моль = 2,24 г.
Перевіримо, чи правильно ми розв’язали задачу.
Маса пластинки після реакції:
M1(пласт.) = m(пласт.) + m(Cu) – m(Fe);
M1(пласт.) = 50 г + 2,56 г – 2,24 г = 50,32 г.
Отже, розв’язок правильний.
ІІ спосіб
2. Обчислимо кількість речовини заліза і міді, що беруть участь у реакції, склавши алгебраїчне рівняння.
Позначимо кількість однієї з цих речовин, наприклад міді, х моль. Кількість речовини заліза, яке при цьому переходить у розчин, за співвідношенням речовин у рівнянні реакції так само х моль.
N(Cu) = х моль; n(Fe) = х моль.
Маса міді, що осіла на пластинці:
M(Cu) = M – n; m(Cu) = 64х.
Маса заліза, яке переходить у розчин:
M(Fe) = M – n; m(Fe) = 56.
Маса пластинки після реакції дорівнює:
M1(пласт.) = m(пласт.) + m(Cu) – m(Fe);
50,32 = 50 + 64х – 56х;
Металічні елементи та їх сполуки
0,32 = 8х; х = 0,04 моль;
N(Cu) = 0,04 моль; n(Fe) = 0,04 моль.
3. Обчислимо масу міді, що осіла на пластинці:
M(Cu) = M – n; m(Cu) = 64 г/моль – 0,04 моль = 2,56 г.
4. Обчислимо масу заліза, що переходить у розчин:
M(Fe) = Mn; m(Fe) = 56 г/моль – 0,04 моль = 2,24 г.
В і д п о в і д ь. У розчин переходить 2,24 г заліза, на пластинці осідає 2,56 г міді.
Поміркуємо, чи завжди взаємодія між розчином солі та металом супроводжується збільшенням маси пластинки.
Як ви дізналися, причиною зміни маси пластинки є різниця між масами металу, який переходить у розчин, і металу, що осідає на пластинці, з урахуванням стехіометричних співвідношень речовин у рівнянні реакції.
За умовою розв’язаної задачі, збільшення маси пластинки зумовлено тим, що молярна маса міді – металу, який осідає на пластинці (64 г/моль), більша за молярну масу металу – заліза, що переходить у розчин (56 г/моль), а кількості речовини кожного металу за рівнянням реакції однакові (1 моль).
У якому випадку маса пластинки зменшуватиметься?
Логічно припустити, якщо молярна маса металу, що осідає на пластинці, буде меншою за молярну масу металу, який переходить у розчин, а кількості речовини кожного металу за рівнянням реакції однакові, то маса пластинки зменшуватиметься.
Наприклад, зменшення молярної маси спостерігаємо, якщо цинкова пластинка занурена у розчин мідного купоросу:
Zn + CuSO4. = ZnSO4 + Cu
M(Zn) = 65 г/моль, n(Zn) = 1 моль
M(Cu) = 64 г/моль, n(Cu) = 1 моль
При взаємодії реагентів кількістю речовин 1 моль маса пластинки зменшиться на 1 г.