Розрахунки за хімічними формулами
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 9
Тема. Розрахунки за хімічними формулами
Цілі уроку: систематизувати знання про кількість речовини, молярну масу, молярний об’єм; удосконалювати навички обчислень за хімічними формулами; підготувати учнів до тематичного оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами”.
Тип уроку: узагальнення й систематизації знань.
Форми роботи: групова, індивідуальна.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання
1. Два-три учні пропонують складені вдома задачі на обчислення відносної густини газоподібних речовин.
2. На дошці виписуємо формули зв’язку:
– кількості речовини и маси:  = m/M;
= m/M;
– кількості речовини и числа частинок:  = N/NA;
= N/NA;
– кількості речовини и об’єму газів:  = V/Vm;
= V/Vm;
– попарно взяті кількості речовини реагентів і продуктів реакції:  1/k1 =
1/k1 =  2/k2, де k1 і k2 – коефіцієнти
2/k2, де k1 і k2 – коефіцієнти
– об’ємів газоподібних речовин – реагентів і продуктів реакції: V1/k1 = V2/k2.
III. Узагальнення й систематизація вивченого матеріалу
Групова робота
1. Учні об’єднуються в групи, одержують завдання на аркуші формату А3, виконують відповідні розрахунки, заповнюють вільні клітинки в таблиці. Потім по колу обмінюються аркушами, червоним чорнилом виправляють помилки й вивішують аркуші на дошці.
Після цього по черзі коментують допущені помилки.
Учитель узагальнює відповіді (10-15 хв.).
Варіант І
NaCl | СO2 | H2SO4 |
Т, г | 58,5 | |
М, г/моль | ||
| 2 | |
N, частинок | ||
V, л | 11,2 |
Варіант II
SO2 | Аl(ОН)3 | СuО |
Т, г | 16 | |
М, г/моль | ||
| 12,04 – 1023 | |
N, частинок | ||
V, л | 44,8 |
Варіант III
СаСО3 | CO | HCl |
Т, г | 150 | |
М, г/моль | ||
| ||
N, частинок | 9,03 – 1023 | |
V, л | 56 |
Варіант IV
АlСl3 | N2 | H2CO3 |
Т, г | 26,7 | |
М, г/моль | ||
| 3 | |
N, частинок | ||
V, л | 33,6 |
2. Кожна група одержує завдання (5 хв.)
Обчисліть об’єм вуглекислого газу, що утвориться в результаті згоряння природного газу, який містить метан об’ємом:
Група 1 – 5 л;
Група 2 – 3 л;
Група 3 – 7 л;
Група 4 – 10 л.
Який об’єм кисню з повітря при цьому витрачається?
Записуємо на дошці рівняння реакції й під рівнянням виписуємо відповіді всіх груп.
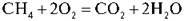
Варіант І | 5 л | 10 л | 5 л |
Варіант II | 3 л | 6 л | 3 л |
Варіант III | 7 л | 14 л | 7 л |
Варіант IV | 10 л | 20 л | 10 л |
3. Яка кількість речовини кисню знадобиться для повного згоряння речовини X кількістю речовини 0,5 моль?
X: група 1 – Аl; група 2 – Р; група 3 – Mg; група 4 – Li.
Кожна група наводить рівняння реакції, складає пропорцію й записує відповідь. Потім групи по колу обмінюються розв’язаннями, перевіряють, виправляють, коментують.
Учитель узагальнює відповіді.
Група 1
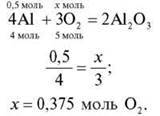
Група 2
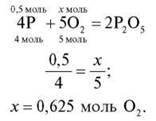
Група 3
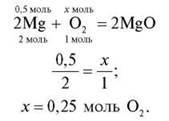
Група 4
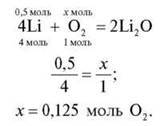
IV. Підбиття підсумків уроку. Рефлексія
Ще раз звертаємо увагу на виписані на дошці формули.
– Де на уроці ми використали ці формули?
– Яка група швидше й правильніше виконувала завдання?
– Які помилки допускалися в процесі виконання завдань?
V. Домашнє завдання
Повторити матеріал теми, підготуватися до тематичного оцінювання.
Творче завдання. Заповнити таблицю.
2Na | +Сl2 | = 2NaCl |
M, г | 4,6 | |
| ||
V, л | – | – |