Сірководень (гідроген сульфід). Сірководнева (сульфідна) кислота. Сульфіди – Елементи VIA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.3. Елементи VIA Групи
9.3.7. Сірководень (гідроген сульфід). Сірководнева (сульфідна) кислота. Сульфіди2
Сірководень та сірководнева кислота Сірководень, або гідроген сульфід H2S,- летка сполука Сульфуру з Гідрогеном. У молекулі сірководню атом Сульфуру утворює два ковалентні полярні зв’язки з двома атомами Гідрогену. Валентний кут становить 92,1°. Розчин H2S у воді називають сірководневою
Поширеність сірководню в природі
У природі сірководень трапляється в складі природних та вулканічних газів, міститься у воді деяких мінеральних джерел, також утворюється при розкладанні органічних речовин (рослинних та тваринних решток), а тому в невеликій кількості міститься в повітрі.
Величезні запаси сірководню накопичені в глибинах Чорного моря: його шар починається з глибини 150-200 м і досягає дна (максимальна глибина – 2210 м). Концентрація сірководню на глибині 150 м – 0,19 мг/л морської води, на глибині 200 м – 0,83 мг/л, а на глибині 2000 м сягає 9,60 мг/л. Таким чином, за винятком деяких
Фізичні властивості та фізіологічна дія сірководню
Сірководень – безбарвний газ з різким неприємним запахом тухлих яєць – віл води розчиняється до 2,5 л H2S. Сірководень дуже отруйний. Наявність у повітрі об’ємної частки 0,1 % викликає отруєння. Гідроген сульфід зв’язує гемоглобін, утворюючи з йоном Fe2+, що входить до його складу, малорозчинну сполуку – ферум(ІІ) сульфід.
Добування сірководню
У лабораторії для добування сірководню використовують реакцію між сульфідом металічного елемента і хлоридною кислотою або розбавленою сульфатною кислотою:
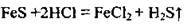
У промисловості сірководень добувають, пропускаючи водень над розплавленою сіркою:
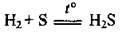
Хімічні властивості сірководню та сульфідної кислоти
Сірководень
1. Сірководень горить блакитним полум’ям:
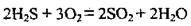
За нестачі кисню утворюється сірка:
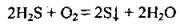
2. Сірководень відносять до сильних відновників – він може окислюватись до сірки, сульфур(ІV) оксиду чи сульфатної кислоти:

3. Гідроген сульфід взаємодіє з кислотами-окисниками:
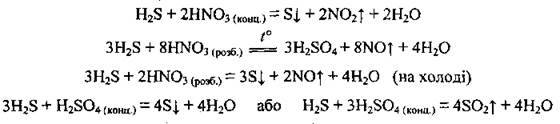
4. Реагує і з сильними, і зі слабкими окисниками:
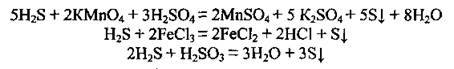
Використання сірководню
1. У хімічній промисловості для отримання сульфатної кислоти, елементарної сірки, сульфідів.
2. В органічному синтезі сульфуровмісних речовин (тіолів3).
3. Як реагент в аналітичній хімії для виявлення іонів важких металічних елементів (Ag+, Pb2+, Сu2+).
4. У перспективі можливе використання гігантських запасів сірководню, які містяться в Чорному морі для потреб сірководневої енергетики і хімічної промисловості.
5. У медицині природні джерела і штучні ванни, що містять сірководень, використовують для боротьби зі шкірними захворюваннями.
Сульфідна кислота
Розчин сірководню у воді – сірководнева вода, або сірководнева (сульфідна) кислота, – слабка двохосновна кислота. Вона слабкіша за сульфітну кислоту H2SO3. Дисоціює двоступенево (за II ступенем – у незначній мірі):
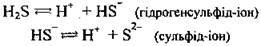
Сульфідна кислота виявляє загальні властивості кислот. Вона реагує з основними оксидами, основами, утворюючи середні та кислі солі, а також з деякими солями та металами:
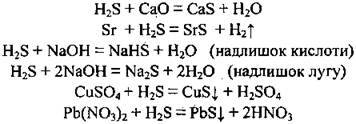
Солі сірководневої кислоти
Сірководнева кислота утворює два ряди солей: середні – сульфіди (K2S, CaS) – та кислі – гідрогенсульфіди (KHS, Ca(HS)2). Розчинними у воді є сульфіди лужних і лужноземельних металічних елементів, а також амоній сульфід (NH4)2S. Деякі сульфіди мають характерне забарвлення: чорне – PbS та CuS, жовте – CdS, біле – ZnS, MgS, рожеве – MnS.
Хімічні властивості сульфідів
1. Розчинні у воді сульфіди повільно гідролізують, тобто розкладаються водою:
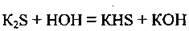
Унаслідок повного гідролізу в розчині деякі сульфіди одержати неможливо:
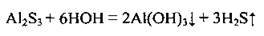
2. Сульфіди реагують з деякими іншими солями:
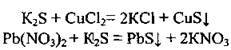
Ці дві реакції є якісними на виявлення сульфід-іона S2-, адже спостерігається утворення характерних осадів чорного кольору – CuS та PbS.
3. Сульфіди розкладаються сильнішими кислотами:
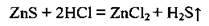
4. Сульфіди при взаємодії з окисниками виявляють відновні властивості:

______________________________________________________________
1 Реакцію використовують для зв’язування розлитої ртуті (демеркуризація). Ділянку підлоги, де розбився ртутний термометр, необхідно посипати порошком сірки. Кіновар – неотруйна сполука. Вона не випаровується (за кімнатної температури) і легко може бути зібрана.
2 Полісульфіди – сполуки Сульфуру із загальною формулою X2Sn, структура яких містить ланцюжки атомів – S-S(n-2)-S-, де, залежно від компонента X, n може змінюватись: у полісульфідах ГідрогенуH2Sn (оліїсті рідини залежно від вмісту Сульфуру від жовтого до червоного кольору) п змінюється від 2 до 23, у полісульфідах амонію (NH4)2Sn – від 2 до 9, лужних металів Me2Sn – від 2 до 8. Їх використовують у шкіряній промисловості (для видалення волосся зі шкіри), у виробництві барвників, полісульфідних каучуків, в аналітичній хімії.
3 Тіоли (або меркаптани) мають сильний неприємний запах. Зокрема, егантіол C2H5SH додають до природного газу (у метану запаху немає) перед його подачею в побутовий газогін, щоб виявити витікання газу із системи.