СУЛЬФАТНА КИСЛОТА Й СУЛЬФАТИ
ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ
УРОК 9. СУЛЬФАТНА КИСЛОТА Й СУЛЬФАТИ
Цілі: формувати знання про склад сульфатної кислоти й сульфатів, їх властивості й застосування, найважливіші природні сульфати, особливості охорони навколишнього середовища від забруднення викидами сульфуровмісних речовин; формувати вміння складати формули сульфатів і рівняння реакцій, що характеризують властивості сульфатної кислоти й сульфатів.
Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер.
Тип уроку: вивчення
Форми роботи: евристична лекція, демонстраційний експеримент, доповіді учнів, прийоми “Експрес-тести”, “Взаємоперевірка”
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань
Прийом “Експрес-тести”
1. Укажіть ряд сполук, у якому є лише оксиди:
А) CaO, K2SO3;
Б) Na2O, SO2, Fe2O3;
В) CO2, HCl, NaOH;
Г) SiO2, CaBr2, Li2O.
2. Укажіть сполуку, яка не належить до оксидів:
А) SO2;
Б) H2SO4;
В) H2O;
Г) MgO.
3. Укажіть формулу кислотного оксиду:
А) K2O;
Б) CaO;
В) CO2;
Г) Al2O3.
4. Укажіть ряд сполук, у якому є лише трьохосновні кислоти:
А) H3AsO4,
Б) H2S, H2SO3, HBr;
В) H3PO4, HCl, H2SO4;
Г) HF, H3AsO4, H2S.
5. Укажіть класифікаційну приналежність сполуки N2O5:
А) оксигеновмісна кислота;
Б) основний оксид;
В) кислотний оксид;
Г) амфотерний оксид.
6. Укажіть формулу оксиду, гідрат якого є сульфатною кислотою:
А) SO3;
Б) CO2;
В) SO2;
Г) SiO2.
7. Укажіть сполуки, які взаємодіють з водою:
А) SO2;
Б) SiO2;
В) NaCl;
Г) CO2.
8. Укажіть формули несолетворних оксидів:
А) N2O;
Б) CO;
В) CO2;
Г) Al2O3.
9. Укажіть оксиди неметалів, які не взаємодіють з лугами:
А) NO2;
Б) CO;
В) SO3;
Г) NO.
10. Укажіть речовини, з якими може взаємодіяти SO2:
А) NaOH;
Б) H2SO4;
В) NaCl;
Г) MgO.
Перевірка роботи здійснюється через проектування відповідей на екран. Учні в парах перевіряють правильність виконання завдань (прийом “Взаємоперевірка”).
III. Мотивація навчальної діяльності. Оголошення теми й мети уроку
IV. Вивчення нового матеріалу
Завдання. Запишіть формулу сульфатної кислоти, визначте ступінь окиснення елементів; запишіть формулу кислотного оксиду, гідратом якого є сульфатна кислота.
Фізичні властивості кислоти. Правила техніки безпеки під час роботи із сульфатною кислотою. (Можна скомбінувати роботу з підручником, доповіді та пояснення учнів.)
Демонстраційний дослід. Виділення теплоти під час розчинення у воді концентрованої сульфатної кислоти
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.)
Демонстраційний дослід. Водовідбірні властивості концентрованої сульфатної кислоти (дія на цукор і папір)
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.)
Хімічні властивості сульфатної кислоти
(Пояснення супроводжується демонстраціями.)
1. Дисоціація кислоти (ступінчаста):
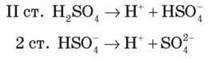
2. Взаємодія з основами:
2KOH + H2SO4 = K2SO4 + 2H2O
3. Взаємодія з оксидами металів:
CuO + H2SO4 = CuSO4 + H2O
4. Взаємодія із солями:
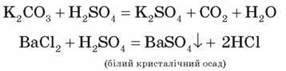
5. Взаємодія з металами:
А) розбавлена
Zn + H2SO4 = ZnSO4 + H2
Б) концентрована
Cu + 2H2SO4  CuSO4 + SO2 + 2H2O.
CuSO4 + SO2 + 2H2O.
(H2S, S)
Fe, Al, Cr – на холоді пасивують.
Au, Pt – не реагують.
Завдання: скласти формули п’яти солей сульфатної кислоти й дати їм назви.
Демонстраційний дослід. Ознайомлення зі зразками природних сполук Cульфуру
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.)
Демонстраційний дослід. Якісна реакція на сульфат-іон
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.)
Якісна реакція на сульфат-іон:
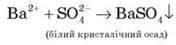
V. Осмислення отриманих знань
Доповіді учнів із презентаціями.
1. Застосування сульфатної кислоти й сульфатів.
2. Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.
VI. Підбиття підсумків уроку
VII. Домашнє завдання