Відносні атомні маси хімічних елементів
Тема 1 Початкові хімічні поняття
& 7. Відносні атомні маси хімічних елементів
Опанувавши цю тему, ви зможете:
– розуміти кількісну характеристику атома;
– розрізняти поняття “відносна атомна маса” і “маса атома”;
– знати одиницю, щодо якої обчислюють відносні атомні маси елементів, а також першу класифікацію елементів на металічні й неметалічні;
– уміти знаходити значення відносних атомних мас елементів за періодичною системою;
– набувати здатності користуватися довідковими джерелами
– оцінювати важливість знань про хімічні елементи й маси атомів.
Реальне існування атомів наштовхнуло Дж. Дальтона на думку про масу атома хімічного елемента. Дослідженнями вченого було встановлено, що маси атомів дуже малі. Наприклад, маса атома Гідрогену становить 1,66 ∙ 10-24 г або 1,66 ∙ 10-27 кг, а Оксигену – 2,67 ∙ 10-23 г або 2,67 ∙ 10-26 кг. Запам’ятати такі числа надзвичайно важко, а користуватися ними під час обчислень дуже незручно. Через це па початку XIX ст. вчений запропонував увести еталон порівняння маси, тобто одиницю, відносно якої можна розглядати абсолютні атомні маси. Такою одиницею було
Атомна одиниця маси – це 1/12 маси Карбону, що чисельно дорівнює масі атома Гідрогену 1,66 ∙ 10-24 г.
Якщо поділити значення мас атомів елементів на чисельне значення атомної одиниці маси, то отримаємо невеликі цілі числа, які відповідають відносній атомній масі цього елемента. Відносну атомну масу скорочено позначають Аɒ читається а-ер, де А означає “атомна”, а r – “відносна”, від латинського слова relativus.
Наприклад, обчислимо відносні атомні маси Гідрогену й Флуору:
Ar(H) = 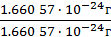 = 1;
= 1;
Ar(F) = 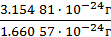 = 18,9984 ≈ 19.
= 18,9984 ≈ 19.
Відносна атомна маса – це число, яке показує, у скільки разів маса атома відповідного елемента більша від 1/12 маси атома Карбону:
Ar(E) = 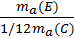 .
.
Оскільки відносна атомна маса є відношенням реальної маси атома елемента до обраного еталона, то вона – безрозмірна величина.
– Знайдіть у періодичній системі хімічних елементів відносні атомні маси Натрію, Карбону, Силіцію, Цинку, Алюмінію, Хлору й назвіть їх. Що особливе ви помітили в цих числах?
Відносні атомні маси всіх хімічних елементів обчислені та внесені в періодичну систему. Найчастіше це дробові числа. Для хімічних розрахунків використовують округлені їх значення (див. табл. 1).
Відносні атомні маси є середнім значенням усіх ізотопів (різновидностей атомів) цього елемента. Наприклад, в Оксигену є 3 ізотопи, ядра яких містять однакове число протонів, але різну кількість нейтронів (рис. 36).
Більшість атомів Оксигену, які трапляються в природі, мають відносну масу 16. Тому й відносна атомна маса елемента, наближена до цього значення, становить 15,999. Як і в Оксигену, відносні атомні маси інших елементів унесеш в періодичну систему хімічних елементів як числа, переважно заокруглені до тисячних часток одиниці.
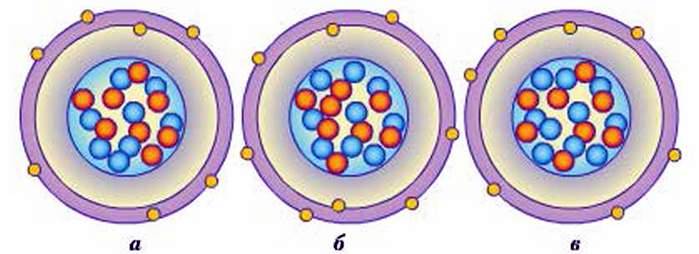
Рис. 36. Моделі ізотопів Оксигену з масою:
А – 16 (8 протонів і 8 нейтронів); б – 17 (8 про гонів і 9 нейтронів); в – 18 (8 протонів і 10 нейтронів)
ПІДСУМОВУЄМО ВИВЧЕНЕ
– Атоми хімічних елементів характеризуються певними масами. Абсолютні маси атомів є дуже малими, тому для зручності користування введено поняття “відносна атомна маса”.
– Відносна атомна маса – величина безрозмірна. Чисельно вона дорівнює відношенню маси атома відповідного елемента до 1/12 маси атома Карбону.
– За атомну одиницю маси взято 1/12 маси атома Карбону. Це величина, що становить 1,66 ∙ 10-24 г або 1,66 ∙ 10-27 кг і позначається а. о. м.
– Відносні атомні маси хімічних елементів унесено в таблицю “Періодична система хімічних елементів”.
ЗАВДАННЯ ДЛЯ КОНТРОЛЮ ЗНАНЬ
1. Назвіть поняття, якими можна користуватися для кількісної характеристики атомів хімічних елементів.
2. Поясніть, яку одиницю в хімії називають атомною одиницею маси (а. о. м.).
3. Охарактеризуйте поняття “абсолютна атомна маса” і “відносна атомна маса”. Чим вони відрізняються?
4. Напишіть математичний вираз відносної атомної маси, дайте пояснення.
5. Обчисліть відносну атомну масу Карбону, якщо абсолютна атомна маса становить 19,93 ∙ 10-24 г.
6. Оцініть важливість знань про хімічні елементи.
ЦІКАВО ЗНАТИ
Надмірний уміст чи нестача багатьох хімічних елементів в організмі людини викликають патологічні зміни у функціях окремих органів.
Елементи в складі сполук мають здатність нагромаджуватися в різних органах: Хром, Аргентум, Молібден – у мозку; Манган, Калій – у серці; Аурум – у жіночому волоссі; Цинк – у зубах тощо.
За нестачі Феруму порушується робота імунної системи й концентрація уваги, випадає волосся, виникають депресивні явища. Без нього неможливе функціонування кровоносної системи. Ферум необхідний не тільки людині, а й рослинним і тваринним організмам.