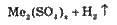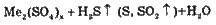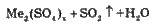Головна ⇒ 📌Формули й таблиці ⇒ Взаємодія сульфатної кислоти H2SO4 з металами – ХІМІЯ
Взаємодія сульфатної кислоти H2SO4 з металами – ХІМІЯ
Формули й таблиці
ХІМІЯ
Взаємодія сульфатної кислоти ( H 2 SO 4 ) з металами
Концентрація кислоти | Метали (в електрохімічному ряді напруг) | Продукти взаємодії |
Розведена | Зліва від Гідрогену |
|
Справа від Гідрогену | Не взаємодіє | |
Концентрована | Fe, Cr, Аl, Pt, Au | Не взаємодіє |
Зліва від Гідрогену |
| |
Справа від Гідрогену |
|
Related posts:
- Взаємодія нітратної кислоти HNO3 з металами – ХІМІЯ Формули й таблиці ХІМІЯ Взаємодія нітратної кислоти ( HNO 3 ) з металами Концентрація кислоти Метали (в електрохімічному ряді напруг) Продукти взаємодії Розведена Від Li до Zn з дуже розведеною HNO3 Від Fe до Н з дуже розведеною HNO3 Справа від Гідрогену Концентрована Fe, Cr, Аl, Pt, Au, Os, Іr, Та, W Не взаємодіє Від […]...
- Взаємодія нітратної кислоти з металами і неметалами – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.8. Взаємодія нітратної кислоти з металами і неметалами При взаємодії нітратної кислоти з металами водень, як правило, не виділяється: він окиснюється, утворюючи воду. Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук: +5 +4 […]...
- Властивості сульфатної кислоти та її практичне значення – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.7. Властивості сульфатної кислоти та її практичне значення Фізичні властивості. Сульфатна кислота – важка безбарвна оліїста рідина. Надзвичайно гігроскопічна. Поглинає вологу з виділенням великої кількості теплоти, тому не можна воду доливати до концентрованої сульфатної кислоти – відбуватиметься […]...
- СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ У творений при окисненні діоксиду сульфуру триоксид сульфуру – кислотний оксид. Під час його взаємодії з водою утворюється сульфатна кислота Н2SO4: Безводна сульфатна кислота – рідина, густина якої майже у два рази перевищує густину води. Вона змішується з водою у будь-яких пропорціях. Процес […]...
- Солі сульфатної кислоти – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.8. Солі сульфатної кислоти Сульфатна кислота, як двохосновна, утворює два ряди солей: середні, що називаються сульфатами, і кислі, що називаються гідросульфатами. Сульфати утворюються при повній нейтралізації кислоти лугом (на один моль кислоти припадає два молі лугу), а […]...
- Виробництво сульфатної кислоти РОЗДІЛ 4 ПРОМИСЛОВЕ ВИРОБНИЦТВО НАЙВАЖЛИВІШИХ НЕОРГАНІЧНИХ РЕЧОВИН § 71. Виробництво сульфатної кислоти Усвідомлення змісту цього параграфа дає змогу: Характеризувати сировину сульфатно-кислотного виробництва, його стадії і технологічну схему, будову й роботу основних апаратів; складати рівняння хімічних реакцій, що лежать в основі кожної стадії виробництва; Обгрунтовувати оптимальні умови їх здійснення; Пояснювати наукові принципи хімічної технології у виробництві […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Тема 3 ВОДА & 36. ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Вивчення параграфа допоможе вам: · наводити приклади формул кислот і основ; · складати рівняння реакцій води з деякими оксидами; · розпізнавати дослідним шляхом кислоти і луги Вода вступає в хімічні реакції з багатьма речовинами. Розглянемо, як вона взаємодіє з оксидами та […]...
- Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи Тема 3 Вода & 24. Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи Опанувавши цю тему, ви зможете: – розрізняти основи й кислоти як гідрати оксидів; – наводити приклади гідратів оксидів, утворених оксидами неметалічних і металічних елементів; – розпізнавати кислоти й основи, розчинні у воді, за допомогою індикаторів; – складати рівняння реакцій […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА ЛАБОРАТОРНИЙ ДОСЛІД 6 Випробування водних розчинів кислот і лугів індикаторами Речовини та обладнання: пробірки, штатив для пробірок, вода, натрій гідроксид, станова кислота, індикатори. Завдання 1. Користуючись індикаторами, перевіримо, як змінюються їх кольори у воді, водних розчинах кислоти і лугу. Для цього налили в першу пробірку 1 мл води, у другу […]...
- Хімічні властивості спиртів: повне й часткове окиснення, дегідратація, взаємодія з лужними металами, гідрогенгалогенідами II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 30 Тема уроку. Хімічні властивості спиртів: повне й часткове окиснення, дегідратація, взаємодія з лужними металами, гідрогенгалогенідами Цілі уроку: вивчити хімічні властивості спиртів на прикладі насичених одноатомних спиртів – їх повного окиснення, взаємодії з металевим натрієм, гідроген хлоридом; показати зв’язок хімічних властивостей спиртів з наявністю функціональної гідроксильної групи; […]...
- Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп Цілі уроку: формувати знання учнів про хімічні властивості одноосновних карбонових кислот; показати взаємний вплив карбоксильної групи та […]...
- КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ Властивості кислот можуть бути поділені на три групи. Перша група об’єднує загальні властивості кислот, зумовлені наявністю в їхніх розчинах іонів Гідрогену. Це – зміна забарвлення індикаторів, смак, взаємодія з металами, які стоять в ряді напруг металів лівіше Гідрогену, з основними оксидами, лугами, основами. Наведемо відповідні скорочені іонні […]...
- Солі хлоридної кислоти – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.8. Солі хлоридної кислоти Нижче описано найважливіші солі хлоридної кислоти. Хлорид натрію (інші назви: кам’яна сіль, кухонна сіль, галіт) NaCl є приправою до їжі, сировиною для добування гідроксиду натрію, хлору, хлоридної кислоти, соди тощо; використовується для консервування […]...
- ВЗАЄМОДІЯ ГАЛОГЕНІВ З МЕТАЛАМИ Хімія – універсальний довідник ГАЛОГЕНИ ВЗАЄМОДІЯ ГАЛОГЕНІВ З МЕТАЛАМИ Хімічні властивості галогенів, тобто здатність вступати в реакції, утворювати ті або інші сполуки, визначаються їхнім місцем у періодичній системі. Кожен галоген практично завершує період, у якому він знаходиться. Розглянемо спочатку утворення сполуки одного з галогенів, а саме – Хлору з Натрієм. Електронна формула атома Натрію Він […]...
- Насичені монокарбонові кислоти – Карбонові кислоти – Оксигеновмісні органічні сполуки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ 12. Оксигеновмісні органічні сполуки 12.4. Карбонові кислоти Карбонові кислоти – це похідні вуглеводнів, до складу молекул яких входять одна або декілька карбоксильних груп – СООН. Класифікація карбонових кислот Розрізняють: 1) залежно від кількості карбоксильних груп (основності): – монокарбонові (однооснбвні): НСООН мурашина (метанова) кислота […]...
- Кислоти, їх склад і назви. Класифікація кислот Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 13 Тема. Кислоти, їх склад і назви. Класифікація кислот Цілі уроку: розширити знання про класифікацію неорганічних речовин на прикладі кислот; ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот. Тип уроку: поглиблення знань, вивчення нового матеріалу. Форми роботи: робота з опорною схемою, розповідь учителя, демонстраційний експеримент. Обладнання: Періодична […]...
- Послідовність заповнення електронами енергетичних рівнів та підрівнів – ХІМІЯ Формули й таблиці ХІМІЯ Послідовність заповнення електронами енергетичних рівнів та підрівнів 1s22s22p63s23p64s23d104p65s24d105pe6s25d14f145d2-106p67s2…...
- НІТРАТНА КИСЛОТА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ НІТРАТНА КИСЛОТА Найважливішою сполукою Нітрогену є нітратна кислота НNO3. У ній Нітроген проявляє свою вищу валентність +5, як і у відповідному кислотному оксиді N2O5. Для одержання нітратної кислоти у промисловості використовують реакцію: Нітратна кислота (безводна) за звичайних умов є безбарвною рідиною, яка, як і сульфатна кислота, змішується з […]...
- РЯД АКТИВНОСТІ МЕТАЛІВ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ РЯД АКТИВНОСТІ МЕТАЛІВ За числовим значенням своєї відновної здатності всі метали можуть бути розташовані в ряд, який називається р я д о м активності мета л і в. Його називають ще електрохімічним рядом, підкреслюючи тим самим, що, вступаючи в хімічну реакцію, метал віддає електрони – носії електричного струму. […]...
- Кислоти – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.2. Кислоти Означення класу кислот з погляду теорії електролітичної дисоціації див. § 5.8. Наведені там приклади рівнянь їх дисоціації можна записати точніше, із урахуванням гідратації іонів: НСl (газ) ⇆Н+ (водн.) + Сl (водн.); СН3СООН (водн.) […]...
- Оксиди фосфору і фосфатні кислоти – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.11. Оксиди фосфору і фосфатні кислоти Оксиди фосфору. Фосфор утворює декілька оксидів. Найважливішими з них є Р4О6 та Р4О10. Часто їх формули пишуть у спрощеному вигляді як Р2О3 та Р2О5 (індекси попередніх поділено на 2). Оксид фосфору(ІІІ) […]...
- КЛАСИ ОРГАНІЧНИХ РЕЧОВИН – ХІМІЯ Формули й таблиці ХІМІЯ КЛАСИ ОРГАНІЧНИХ РЕЧОВИН Назва класу Представники класу Структурна формула Назва Вуглеводні Ациклічні (аліфатичні) Насичені (алкани) Етан Ненасичені Алкени Етен (етилен) Алкіни Етин (ацетилен) Алкадієни 1,3-бутадієн Циклічні Аліциклічні Циклопропан Ароматичні Бензен Гідроксильні Похідні вуглеводнів Спирти Одноатомні Етанол Двохатомні 1,2-етандіол (етиленгліколь) Трьохатомні 1,2,3-пропантріол (гліцерин) Феноли Фенол Етери Диетиловий етер Альдегіди Етаналь (оцтовий альдегід) […]...
- Розчинність кислот, основ та солей у воді – ХІМІЯ Формули й таблиці ХІМІЯ Розчинність кислот, основ та солей у воді H+ NH4+ Na+ K+ Ва2+ Са2+ Mg2+ Аl3+ Сr3+ Fe3+ Fe2+ Мn2+ Zn2+ Ag+ Hg22+ Hg2+ Сu2+ Рb2+ Ві3+ Sn2+ F- Р Р Р Р М Н Н Р Р Р М М М Р Н М Н Н Н Р Cl- Р Р […]...
- ВЛАСТИВОСТІ СУЛЬФАТНОЇ ТА НІТРАТНОЇ КИСЛОТ, СУЛЬФАТІВ I НІТРАТІВ ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 11. ВЛАСТИВОСТІ СУЛЬФАТНОЇ ТА НІТРАТНОЇ КИСЛОТ, СУЛЬФАТІВ I НІТРАТ ІВ Цілі: закріпити знання про сульфатну й нітратну кислоти, сульфати й нітрати, їх властивості; формувати вміння складати формули сполук і хімічні рівняння, що характеризують їх властивості. Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер. Тип уроку: закріплення (розвивальне диференційоване навчання). […]...
- Карбонові кислоти. Насичені карбонові кислоти. Фізичні властивості. Номенклатура II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 37 Тема уроку. Карбонові кислоти. Насичені карбонові кислоти. Фізичні властивості. Номенклатура Цілі уроку: розвивати знання учнів про карбонільні органічні сполуки на прикладі карбонових кислот; формувати знання про карбоксильну функціональну групу на прикладі карбонових кислот; ознайомити учнів зі структурною й електронною формулами оцтової кислоти; показати зв’язок між функціональною […]...
- Відносні молекулярні маси деяких неорганічних речовин – ХІМІЯ Формули й таблиці ХІМІЯ Відносні молекулярні маси деяких неорганічних речовин H+ NH4+ Na+ K+ Ba2+ Ca2+ Mg2+ Al3+ Cr3+ Fe3+ Fe2+ Mn2+ Zn2+ Ag+ Cu2+ Pb2+ Sn2+ O2- 62 94 153 56 40 102 152 160 72 71 81 232 80 223 135 F- 20 37 42 58 175 78 62 84 109 113 94 […]...
- Відносні електронегативності за шкалою Полінга (у перерахунку Олдера) – ХІМІЯ Формули й таблиці ХІМІЯ Відносні електронегативності за шкалою Полінга (у перерахунку Олдера) Періоди Групи I II III IV V VI VII VIII 1 H 2,20 – – – – – – – – He 2 Li 0,98 Be 1,57 В 2,04 С 2,55 N 3,04 O 3,44 F 3,98 – – Ne 3 Na 0,93 […]...
- КИСЛОТИ І ОСНОВИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ І ОСНОВИ Загальним для всіх кислот при їх взаємодії з водою є утворення іона оксонію Н3O+ (саме цей іон, зокрема, викликає зміну забарвлення індикаторів), тому більш точне визначення класу речовин-кислот порівняно з тим, яке було подано раніше, таке: Кислотою називається речовина, яка при взаємодії з водою (при розчиненні у […]...
- Хлороводень і хлоридна кислота – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.7. Хлороводень і хлоридна кислота Хлороводень – одна з найважливіших сполук хлору. Це безбарвний газ із різким запахом. Під час вдихання подразнює дихальні шляхи і викликає ядуху. В 1,3 раза важчий за повітря. У вологому повітрі “димить”, […]...
- КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН – ХІМІЯ Формули й таблиці ХІМІЯ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН Назва класу Представники класу Молекулярна формула Назва Оксиди Солетворні Основні Na2O Натрій оксид Кислотні SO3 Сульфур(VІ) оксид Амфотерні Al2O3 Алюміній оксид Несолетворні СО Карбон(ІІ) оксид Основи Розчинні у воді (луги) КОН Калій гідроксид Нерозчинні у воді Сu(ОН)2 Купрум(II) гідроксид Амфотерні Zn(OH)2 Цинк гідроксид Однокислотні LiOH Літій гідроксид Багатокислотні […]...