Характеристика хімічних елементів – ГАЛОГЕНИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ГАЛОГЕНИ
Характеристика хімічних елементів
Властивості хімічних елементів
Властивість | Флуор | Хлор | Бром | Йод |
Хімічний символ | F | Сl | Вr | І |
Порядковий номер | 9 | 17 | 35 | 85 |
Атомна маса | 18,99840 | 35,453 | 79,904 | 126,9045 |
Місце | 2 період; VII група | 3 період; VII група | 4 період; VII група | 5 період; VII група |
Число електронів на енергетичних рівнях | 2; 7 | 2; 8; 7 | 2; 8; 18; 7 | 2; 8; 18; 18; 7 |
Радіус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 |
Потенціал іонізації, еВ | 17,42 | 12,97 | 11,81 | 10,45 |
Спорідненість з електроном, еВ | 3,5 | 3,6 | 3,5 | 3,3 |
Відносна електронегативність | 3,96 | 3,19 | 2,74 | 2,21 |
Електронна | 2s22p5 | 3s23p5 | 4s24p5 | 5s25р5 |
Можливі валентності | І | І, III, V, VII | І, III, V, VII | І, III, V, VII |
Можливі ступені окиснення | -1,0 | -1, 0, +1, +3, +4, +5, +7 | -1, 0, +1, +3, +5, +7 | -1, 0, +1, +3, +5, +7 |
Ізотопний склад | 19F – 100% | 35Сl – 75,53%; 37Сl – 24,47% | 79Вr – 50,64 %; 81Вr – 49,36% | 127І – 100% |
Вміст у земній корі, мол. % | 2,8 ∙ 10-2 | 2,6 ∙ 10-2 | 8,5 ∙ 10-2 | 4 ∙ 10-6 |
Зазначені вище елементи VII групи головної підгрупи називають іще галогенами (до цієї групи входить також астат At). Таку назву ця група елементів одержала внаслідок того, що більшість природних солей містять у своєму складі один із цих атомів, а їхня назва, галогени, у перекладі з грец. означає “ті, що народжують сіль” (від галос – сіль і генос – походження).
Здатність проявляти ту чи іншу валентність визначається числом електронних орбіталей, спроможних утворювати хімічний зв’язок. Таким чином, атом Флуору проявляє тільки одну валентність, тимчасом як решта елементів проявляють змінну валентність.
Електронна будова атомів Флуору й Хлору зображена на поданій далі схемі. В атомів Брому та йоду валентні рівні подібні до конфігурації атома Хлору.
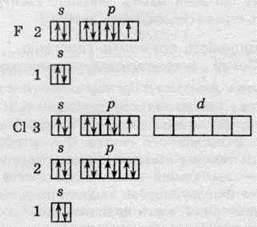
Для утворення хімічного зв’язку Флуор має лише один неспарений електрон, тому Флуор проявляє тільки одну валентність, яка дорівнює одиниці.
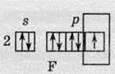
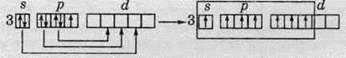
У третьому періоді й вище, де розташовані атоми Хлору, Брому та Йоду, можливий електронний перехід з р-підрівня на d-підрівень, за рахунок цього проявляється більше число валентностей. Наочно такий процес зображений на схемах, які показують утворення різних валентних станів атома Хлору.
Тривалентний стан атома Хлору:
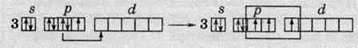
П’ятивалентний стан атома Хлору:
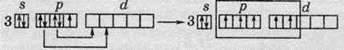
Семивалентний стан атома Хлору:
Серед усіх елементів Періодичної системи атом Флуору має найвищу електронегативність, тому при утворенні зв’язку в будь-яких сполуках атом Флуору здатний тільки приймати електрон і проявляти ступінь окиснення, який дорівнює -1:

За аналогічним механізмом проявляють ступінь окиснення -1 атоми Хлору, Брому та Йоду. Однак за рахунок великих розмірів атомів та меншої електронегативності, ніж в атома Флуору, інші галогени можуть проявляти відновні властивості. Атоми Хлору, Брому та Йоду здатні віддавати 1, З, 5 або 7 електронів атомам-окисникам.
Атоми Флуору не можуть віддавати електрони, тому що вони мають найвищу електронегативність серед усіх існуючих атомів.
Поширеність елементів-галогенів на Землі
Флуор є досить поширеним елементом на Землі. Масова частка Флуору дорівнює 6,6 ∙ 10-2 %. На Флуор багаті такі рослини, як цибуля та сочевиця. В організмах тварин Флуор міститься головним чином у кістках, зубах та черепашках. Флуор – необхідний елемент для життя людини. Вміст Флуору в зубах людини підтримується на певному рівні, який дорівнює 0,02 %. У природі Флуор міститься в різних мінералах, таких як флюорит (плавиковий шпат) CaF2, фторапатит Са5(РО4)3F, кріоліт Na3AlF6.
У земній корі міститься 0,05 % Хлору за масою. Хлор входить до складу великої кількості мінералів, однак найбільше хлору в морській воді, де він входить до складу таких розчинених солей, як NaCl, MgCl2 та деяких інших. Однією з найпоширеніших сполук хлору є мінерал галіт, або, як його ще називають, кам’яна сіль NaCl. Величезні підземні поклади натрій хлориду є поблизу міста Артемовська (Донецька область), а також у деяких інших районах. Елемент хлор утворює проста речовина хлор, яка зустрічається в деяких вулканічних газах. Цей елемент входить також до складу таких мінералів, як сильвін КСl, сильвініт NaCl ∙ KCl, карналіт KCl ∙ MgCl2 ∙ 6Н2O, каїніт KCl ∙ MgSO4 ∙ 3Н2O, рогове срібло AgCl.
Бром, порівняно з іншими галогенами, ще менш поширений на Землі. Вміст Брому в земній корі дорівнює приблизно 1,6 ∙ 10-4 %, однак атоми Брому входять до складу одного-єдиного дуже рідкісного мінералу бромаргіриту AgBr. Він не утворює поширених мінералів і досить рівномірно розподілений по всій планеті у вигляді незначної домішки до багатьох мінералів. З огляду на це, отримати цей елемент та застосувати його в промисловості досить важко. Деякі рослини, такі як квасоля, горох та сочевиця, здатні накопичувати бром. Багато брому міститься в золі морських водоростей та в морській воді.
Йод – доволі рідкісний та розсіяний елемент на Землі. Його вміст у земній корі за масою становить приблизно 4 ∙ 10-5 % . Так само, як і Бром, атоми Йоду не утворюють власних мінералів, а містяться тільки у вигляді домішок в інших мінералах. Найбільше йоду міститься у водах деяких солоних озер та Світового океану.