Захист від корозії – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
§ 12.8. Захист від корозії
Корозія металів відбувається безперервно і завдає величезних збитків. Підраховано, що прямі втрати заліза від корозії становлять близько 10 % його щорічної виплавки. Внаслідок корозії металеві вироби втрачають свої цінні технічні властивості. Тому важливе значення мають методи захисту металів та сплавів від корозії. Вони досить різноманітні. Назвемо деякі з них.
Захисні
Створення сплавів з антикорозійними властивостями. Введенням до складу сталі близько 12 % хрому добувають нержавіючу сталь, стійку проти корозії. Добавки нікелю, кобальту і міді посилюють антикорозійні властивості сталі, оскільки підвищується схильність спла-
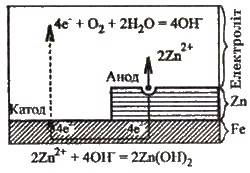
Рис. 12.6. Корозійне руйнування цинку в гальванічній парі Zn | Fe
Вів до пасивації. Створення сплавів з антикорозійними властивостями – один з найважливіших напрямків боротьби проти корозійних втрат.
Протекторний захист і електрозахист. Протекторний захист застосовують у тому разі, коли захищається конструкція (підземний трубопровід, корпус судна), яка перебуває в середовищі електроліту (морська вода, підземні грунтові води та ін.). Суть такого захисту полягає в тому, що конструкцію сполучають з протектором1 – більш активним металом, ніж метал конструкції, яку захищають. Як протектор для захисту стальних виробів звичайно використовують магній, алюміній, цинк та їх сплави. У процесі корозії протектор є анодом і руйнується, запобігаючи тим самим руйнуванню конструкції (рис. 12.7). У міру руйнування протекторів їх замінюють новими.
На цьому принципі грунтується й електрозахист. Конструкцію, яка перебуває в середовищі електроліту, також сполучають з іншим металом (звичайно шматком заліза, рейкою тощо), але через зовнішнє джерело струму. При цьому конструкцію, яку захищають, під’єднують до катода, а метал – до анода джерела струму. Електрони відщеплюються від анода джерелом струму, анод (захисний метал) руйнується, а на катоді відбувається відновлення окисника.
Електрозахист має перевагу над протекторним захистом: радіус дії першого близько 2 000 м, другого – близько 50 м.
Зміна складу середовища. Для уповільнення корозії металевих виробів до електроліту вводять речовини (найчастіше органічні), які називають уповільнювачами корозії, або інгібіторами. їх застосовують у тих випадках, коли метал необхідно захищати від роз’їдання кислотами. Вчені створили ряд інгібіторів (препарати марок ЧМ, ПБ та інші), які при доданні до кислоти в сотні разів сповільнюють розчинення (корозію) металів.
1 Лат. protector – захисник, покровитель.
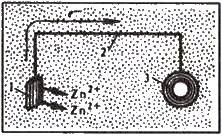
Рис. 12.7. Схема протекторного захисту підземного трубопроводу:
1 – протектор (цинк, він кородує); 2 – провідник струму; 3 – трубопровід (захищений за рахунок електронів цинку)
Останнім часом розроблено леткі (або атмосферні) інгібітори. Ними просочують папір, яким обгортають металеві вироби. Пара інгібіторів адсорбується на поверхні металу і утворює на ній захисну плівку.
Інгібітори широко застосовують при хімічному очищенні від накипу парових котлів, зніманні окалини з оброблених деталей, а також при зберіганні та перевезенні хлоридної кислоти у стальній тарі. До неорганічних інгібіторів належать нітрити, хромати, фосфати, силікати. Механізм дії інгібіторів є предметом дослідження багатьох хіміків.