Оксиди Нітрогену – НІТРОГЕН. ФОСФОР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
НІТРОГЕН. ФОСФОР
Оксиди Нітрогену
Нітроген утворює оксиди, перебуваючи у всіх ступенях окиснення, тобто існують нітроген(І) оксид N2O, нітроген(ІІ) оксид NO, нітроген(ІІІ) оксид N2O3, нітроген(ІV) оксид NO2, нітроген(V) оксид N2O5.
Властивість | N2O | NO | N2O3 | NO2 | N2O5 |
Зовнішній вигляд при н. у. | Безбарвний | Безбарвний газ | Темно-синя рідина | Бурий газ | Безбарвна кристалічна речовина |
Tпл | -91 °С | -164 °С | -101 °С | -11 °С | Tрозкл = +33 °С |
ТКИП | -86 °С | -152 °С | +3 °С | +21 °С | |
Кислотно-основні Властивості | Несолетворний оксид | Несолетворний оксид | Кислотний оксид. Відповідає HNO2 | Кислотний оксид. Відповідає HNO2 та HNO3 | Кислотний оксид. Відповідає HNO3 |
Окисно-відновні властивості | Окисник | Виступає | Переважають окисні властивості | Виступає і окисником, і відновником | Сильний окисник |
Методи добування | Прожарювання амоній нітриту: NH4NO2 = N2O + 2Н2O | Із простих речовин при +3000°С, або за реакцією міді з 30%-ю HNO3: 3Cu + 8HNO = 3Сu(NO3)2 + 2NO + + 4Н2O | Утворюється при спільній конденсації NO та NO2: NO + NO2 = N2O3 | За реакцією міді з концентрованою HNO3: Cu + 4HNO3 = Cu(NO3)2 + + 2NO2 + 2H2O | Добувають відщепленням води від нітратної кислоти за допомогою Р2O5: 2HNO3 + Р2O5 = N2O5 + 2НРO3 |
Стійкість | Розкладається при температурі понад 300 °С | Дуже стійкий | Стійкий | Стійкий | Розкладається із сильним вибухом |
Нітроген(ІІ) оксид
Нітроген(ІІ) оксид являє собою безбарвний газ із низькими температурами плавлення й кипіння (Тпл = -164 °С, Ткип = -152 °С). Він погано розчиняється у воді. З лугами та кислотами-неокисниками нітроген(ІІ) оксид не взаємодіє. Для промислового використання його добувають каталітичним окисненням амоніаку:

У лабораторних масштабах нітроген(ІІ) оксид добувають дією 30 % нітратної кислоти на металічну мідь:
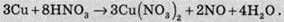
При розряді блискавки він утворюється з азоту та кисню атмосфери. Цей газ є одним із головних джерел сполук нітрогену в грунті Землі:

На повітрі швидко окислюється, при цьому утворюється бурий газ:
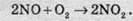
Нітроген(ІІ) оксид проявляє окисні властивості:
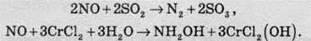
Його застосовують для виробництва сульфатної та нітратної кислот.
Нітроген(І V ) оксид
Нітроген діоксид являє собою газ (Тпл = -11 °С, Ткип = +21 °С) характерного бурого кольору з неприємним, “пекучим” запахом. NО2 зазвичай добувають окисненням нітроген монооксиду киснем повітря, або взаємодією міді з концентрованою нітратною кислотою, або термічним розкладом нітратів малоактивних металів:
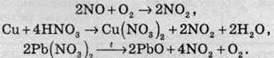
Газ реагує з водою, при цьому проходить реакція диспропорціонування:
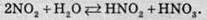
У результаті цієї реакції утворюється сильна нітратна кислота HNО3 та слабка нестійка нітритна кислота HNО2. При взаємодії бурого газу з розчином лугу утворюються дві солі – нітрат (сіль нітратної кислоти) і нітрит (сіль нітритної кислоти):
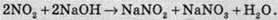
Нітроген діоксид при низьких температурах помітно димеризований (тобто дві однакових молекули з’єднуються в одну):
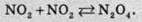
N2О4 – це безбарвна рідина, при нагріванні розкладається на дві молекули нітроген(ІІ) оксиду.
Нітроген діоксид використовують при виробництві нітратної кислоти як гарний нітрувальний агент (речовина, що дозволяє додати в сполуку NO2).
