Азот
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ
§ 31. Азот
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати будову молекули, фізичні та хімічні властивості, способи, добування, застосування азоту;
Складати рівняння та схеми електронного балансу відповідних хімічних реакцій.
Хімічна формула азоту – N2, електронна – :N:::N:, структурна – :N=N:, Mr(N2) = 28, M(N2) = 28 г/моль. Атоми Нітрогену в молекулі азоту сполучаються між собою трьома ковалентними зв’язками:
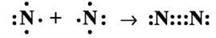
Оскільки
– Поясніть, чому в молекулі азоту ковалентні зв’язки неполярні.
Фізичні властивості. Речовина молекулярної будови, тому за стандартних умов азот – це газ, безбарвний, без запаху і смаку; tкип = -195,8 °С, tпл = -209,86 °С; густина 1,25 г/л; трохи легший за повітря, малорозчинний у воді (в 1 об’ємі води при 20 °С розчиняється 0,0154 об’єму азоту). За температури плавлення азот переходить у рідкий стан, утворюючи снігоподібну масу.
Предмети, занурені у рідкий азот, охолоджуються до -195,8 °С.
Мал. 48. Модель молекули азоту
Наприклад, гумова трубка стає крихкою і легко ламається, а заморожена в рідкому азоті троянда розбивається, ніби зроблена з тонкого скла.
– Виходячи з фізичних властивостей азоту, запропонуйте способи збирання його в посудину та порівняйте зі збиранням водню, хлору і кисню.
Добування. У промисловості азот добувають фракційною дистиляцією зрідженого повітря (одночасно з киснем). Під час поступового нагрівання рідкого повітря азот випаровується першим, оскільки має нижчу температуру кипіння (-195,8 °С), ніж кисень (-183 °С).
У лабораторії азот добувають реакцією між кристалічними натрій (калій) нітритом і амоній хлоридом при нагріванні:
NaNO2 + NH4Cl = NaCl + NH4NO2
Амоній нітрит NH4NO2, що утворюється, розкладається з виділенням вільного азоту:
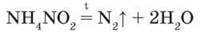
– Визначте типи наведених хімічних реакцій. Для останньої реакції складіть схему електронного балансу.
Хімічні властивості. Азот хімічно малоактивна речовина, бо зв’язок у молекулі дуже міцний, тому вона починає розпадатися на атоми за дуже високої температурі – 4000 °С. Ось чому азот не горить і не підтримує горіння, дихання та життя, про це свідчить і його назва (пригадайте).
– Порівняйте енергії зв’язку (кДж/моль) у молекулах фтору F2 (151), кисню О2 (494) та азоту N2 (942) і поясніть, чому в молекулі азоту зв’язок найміцніший.
Азот – типовий неметал і тому під час хімічних реакцій виявляє переважно властивості окисника, а з більш активними окисниками – властивості відновника.
Окиснювальні властивості виявляються в його здатності приєднувати 3е:
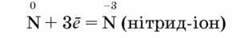
Як окисник азот взаємодіє з металами з утворенням нітридів і воднем – з утворенням амоніаку. Ступінь окиснення Нітрогену в продуктах реакцій -3.
З металів за стандартної температури азот реагує лише з літієм, утворюючи літій нітрид:
6Li + N2 = 2Li3N
За підвищеної температури азот реагує з багатьма металами, утворюючи відповідні нітриди:
3Са + N2 = Са3N2
– Доведіть окиснювальні властивості азоту, склавши схему електронного балансу.
З воднем азот взаємодіє за підвищених тиску і температури та наявності каталізатора. Ця реакція оборотна й екзотермічна:
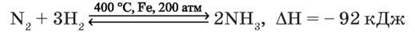
– Поміркуйте, чому цю реакцію треба проводити за таких умов. Для відповіді пригадайте умови збільшення швидкості реакції та зміщення рівноваги у хімічних реакціях, зокрема принцип Ле Шательє (див. § 15). Відновні властивості азоту виявляються в здатності атомів віддавати електрони в реакціях з неметалами за особливих умов:
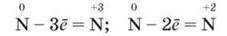
З киснем азот реагує за дуже високих температур. Так, реакція азоту з киснем починається за температури 2000 °С (наприклад, під час електричного розряду):
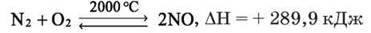
– Поміркуйте, чи може така реакція відбутися у природі, за яких умов. Які властивості виявляє азот? Доведіть їх, склавши схему електронного балансу.
Застосування. У хімічній промисловості азот використовують переважно як сировину для синтезу амоніаку. Застосування в техніці зумовлено його інертністю. В атмосфері азоту виплавляють деякі метали, перекачують горючі рідини, які легко спалахують; ним заповнюють електричні лампи. Рідкий азот використовують, якщо треба розігнати хмари, як холодоагент для швидкого заморожування продуктів, для зберігання крові. У суміші з киснем азот діє як слабкий наркотик, викликаючи стан ейфорії, зменшує больову чутливість.
Коротко про головне
Азот N2 – речовина молекулярної будови, що визначає його фізичні властивості: за стандартних умов – газ, має низькі температури плавлення і кипіння. Атоми в молекулі азоту сполучені потрійним ковалентним зв’язком, що й зумовлює його хімічну інертність. Азот вступає в хімічні реакції лише за певних умов: підвищеного тиску, нагрівання, наявності каталізатора. У реакціях виявляє як окиснювальні, так і відновні властивості (з перевагою перших). Хімічною інертністю азоту пояснюється знаходження його у природі у вільному стані та застосування.
Для допитливих. За стандартних умов азот фізіологічно інертний. Однак при вдиханні повітря під тиском 2-2,5 атм настає стан, подібний до алкогольного сп’яніння; його називають азотним наркозом. Тому в разі потреби використовують штучні газові суміші, в яких азот замінений гелієм або іншим інертним газом.